La cornea
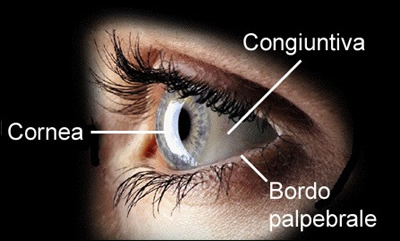 La cornea è una struttura trasparente pluristratificata.
La cornea è una struttura trasparente pluristratificata. Il rivestimento esterno è costituito dall'epitelio, che a sua volta si compone di più strati di cellule.
Una volta asportato (come avviene nella PRK), l'epitelio rigenera dalla periferia e ricopre di nuovo la superficie corneale entro 3 o 4 giorni; tuttavia, prima che si ricostituiscano regolarmente tutti gli strati di cui esso è composto, possono trascorrere alcune settimane: durante questo processo, noto come "riepitelizzazione", la vista può variare in maniera significativa.
L'epitelio è separato dalla porzione più interna di tessuto corneale grazie ad una sottile membrana (di Bowmann), che viene asportata con la PRK, ma non con la LASIK.
Al di sotto della Bowmann si trova lo stroma, lo strato più spesso di tutta la cornea.
Lo stroma rappresenta la parte di tessuto su cui agisce il laser. Al contrario dell'epitelio, esso - una volta asportato - non rigenera; per questo motivo, una sua rimozione parziale modifica permanentemente la forma della cornea.
Il rivestimento interno della cornea è costituito dall'endotelio e non è interessato dalle procedure chirurgiche che sfruttano il laser ad eccimeri.
torna al menù
Cheratocono
 Si definisce cheratocono una malattia degenerativa ereditaria della
cornea caratterizzata da uno sfiancamento dell'apice corneale che assume la forma di un conoide.
Si definisce cheratocono una malattia degenerativa ereditaria della
cornea caratterizzata da uno sfiancamento dell'apice corneale che assume la forma di un conoide.Si possono avere forme lievissime, di cui il paziente non si accorge e che sono diagnosticate solo topograficamente (addirittura solo a carico della superficie posteriore: si parla allora di endocheratocono o cheratocono interno), a forme molto gravi in cui la deformazione e l'assottigliamento della cornea producono un astigmatismo irregolare molto elevato e delle opacità centrali che limitano fortemente la visione.
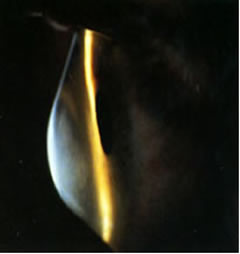
 Tra questi due estremi si osservano tutti i quadri intermedi.
Le forme più lievi possono essere corrette con
occhiali.
Se la deformazione del centro della cornea diventa maggiore l'astigmatismo corneale creatosi rende necessario l'uso di
lenti a contatto rigide; qualora si verifichi intolleranza a lenti a contatto si può fare ricorso all'impianto all'interno dello spessore della cornea di segmenti di plastica rigida che ne rendano più uniforme la curvatura (anelli corneali intra-stromali o INTACS).
Tra questi due estremi si osservano tutti i quadri intermedi.
Le forme più lievi possono essere corrette con
occhiali.
Se la deformazione del centro della cornea diventa maggiore l'astigmatismo corneale creatosi rende necessario l'uso di
lenti a contatto rigide; qualora si verifichi intolleranza a lenti a contatto si può fare ricorso all'impianto all'interno dello spessore della cornea di segmenti di plastica rigida che ne rendano più uniforme la curvatura (anelli corneali intra-stromali o INTACS).In caso di opacità ed assottigliamento marcati bisogna ricorrere al trapianto di cornea: cheratoplastica perforante, cioè di un lembo corneale a tutto spessore, oppure cheratoplastica lamellare profonda, ossia sostituzione di un lembo di cornea che conservi gli strati più profondi. Recentemente sono allo studio degli interventi di cheratoplastica lamellare a guida laser che paiono dare buone prospettive.
Diagnosi
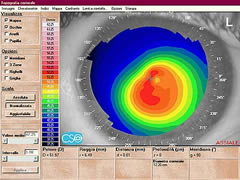
 La diagnosi del cheratocono, eseguibile nelle forme avanzate con la biomicroscopia del segmento anteriore e la cheratometria
durante una routinaria visita oculistica, si avvale nelle forme meno evolute dell'ausilio della topografia corneale.
La diagnosi del cheratocono, eseguibile nelle forme avanzate con la biomicroscopia del segmento anteriore e la cheratometria
durante una routinaria visita oculistica, si avvale nelle forme meno evolute dell'ausilio della topografia corneale.In particolare è fondamentale la topografia corneale altitudinale (ORBSCAN) che mostra la conformazione sia della superficie anteriore, sia di quella posteriore della cornea oltre alla pachimetria corneale (la misura dello spessore della cornea).
La periodica esecuzione di questo esame consente di controllare con precisione l'evoluzione del cheratocono.
Cosa è il trapianto di cornea?
 La cornea è una sottile membrana trasparente, posta davanti all'iride, che costituisce la porzione anteriore del bulbo
oculare; ha lo scopo di far passare le immagini all'interno dell'occhio e di focalizzarle sulla retina.
L'intervento consiste nel sostituire la porzione centrale della cornea opaca del paziente con una trasparente di donatore.
La cornea è una sottile membrana trasparente, posta davanti all'iride, che costituisce la porzione anteriore del bulbo
oculare; ha lo scopo di far passare le immagini all'interno dell'occhio e di focalizzarle sulla retina.
L'intervento consiste nel sostituire la porzione centrale della cornea opaca del paziente con una trasparente di donatore.L'intervento viene effettuato in anestesia locale o generale, in modo ambulatoriale o con ricovero.
Fino ad ora l'intervento chirurgico è sempre stato eseguito in modo strumentale: per effettuare l'asportazione del tessuto corneale il chirurgo si serve di lame e bisturi e di un particolare strumento chiamato trapano corneale che effettua un taglio circolare a tutto spessore. Viene ricreato così uno spazio adatto per ricevere il lembo corneale di donatore che viene prelevato in maniera similare. Si procede poi all'innesto del lembo e successiva sutura. La tecnica con trapano corneale è in uso da alcune decine di anni. Ora l'intervento si può eseguire con il laser chirurgico a femtosecondi (Intralase): per effettuare la rimozione del tessuto corneale si esegue una incisione con il laser che crea un taglio circolare della cornea. Si procede poi all'innesto del lembo del donatore ottenuto sempre con lo stesso strumento ed alla sutura. La tecnica con Intralase è di recentissima introduzione.
 La procedura utilizza Intralase, un sofisticato laser
a femtosecondi;
l'apparecchiatura completamente innovativa permette di perfezionare molti interventi di chirurgia oftalmica
tra cui il trapianto di cornea, uno dei più importanti e difficili interventi sull'occhio; si è aperta
così una nuova possibilità terapeutica per i pazienti che necessitano di trapianto di cornea.
La procedura utilizza Intralase, un sofisticato laser
a femtosecondi;
l'apparecchiatura completamente innovativa permette di perfezionare molti interventi di chirurgia oftalmica
tra cui il trapianto di cornea, uno dei più importanti e difficili interventi sull'occhio; si è aperta
così una nuova possibilità terapeutica per i pazienti che necessitano di trapianto di cornea.A due mesi dall'intervento il risultato dei primi sette casi eseguiti supera di gran lunga le più rosee aspettative ,i pazienti hanno un recupero visivo più veloce, la cornea donata è trasparente già dopo pochi giorni dall'intervento e la ferita operatoria appare più resistente e regolare.
I risultati così positivi fanno ritenere che la tecnica col laser sostituirà nel giro di qualche anno tutte le altre metodiche di trapianto.
Cheratoplastica lamellare
La cheratoplastica lamellare consiste in un trapianto "parziale" della cornea, i cui strati superficiali, opachi o comunque patologicamente alterati, vengono asportati e sostituiti con un lenticolo corneale trasparente proveniente da un donatore.Le indicazioni a questo tipo di intervento possono essere di tipo ottico oppure tettonico (vedi tabella sotto).
Nel primo caso lo scopo è quello di migliorare la vista, nel secondo l'obiettivo è di ristabilire l'integrità strutturale della cornea.
Finalità ottiche
Ricostituzione di un profilo corneale normale: cheratocono, degenerazione pellucidaRimozione di opacità stromali anteriori: cicatrici e distrofie cornealli
Rimozione di irregolarità superficiali: degenerazione di Saltzmann, distrofie epiteliali
Finalità tettoniche
Riparazione di perforazioni cornealiRiparazione di assottigliamenti corneali: descemetocele
Asportazione di tumori benigni corneali
Rispetto alla cheratoplastica perforante, che prevede il trapianto della cornea a tutto spessore, la cheratoplastica lamellare presenta alcuni vantaggi:
- l'intervento non prevede la penetrazione all'interno dell'occhio e pertanto riduce il rischio di complicanze quali l'endoftalmite (infezione dei tessuti intraoculari conseguente a penetrazione di batteri, funghi o virus);
- non c'è rischio di rigetto dell'endotelio, ovvero dello strato più interno della cornea, il quale non viene trapianto;
- non c'è bisogno di istituire una terapia immunosoppressiva a lungo termine;
- maggiore tenuta della sutura e cicatrizzazione più rapida.
Tecnica chirurgica
Esistono numerose tecniche per l'esecuzione della cheratoplastica lamellare, soprattutto per quanto riguarda le modalità di rimozione del tessuto corneale.L'evoluzione delle conoscenze mediche e della tecnologia a nostra disposizione ha portato allo sviluppo della cheratoplastica lamellare a spessori differenziati con laser ad eccimeri.
Questa è la procedura che attualmente fornisce i risultati migliori in termini di recupero visivo e di ridotta incidenza di complicanze.
La cheratoplastica lamellare a spessori differenziati inizia con l'asportazione del tessuto corneale patologico; a tal fine si utilizza un laser specifico - il laser ad eccimeri- che rimuove con precisione (nell'ordine dei micron) lo spessore corneale desiderato dal chirurgo. Rispetto alla rimozione manuale, il laser ad eccimeri consente la creazione di una superficie più regolare ed omogenea.
Il diametro dell'area su cui agisce il laser è di almeno 7 mm, lo spessore di circa 250 micron.
Il raggio laser vaporizza il tessuto corneale (non lo incide né lo brucia). La lunghezza d'onda del laser è tale da impedire al laser stesso di penetrare all'interno dell'occhio: non vi sono pertanto rischi di alterare né tanto meno di danneggiare le strutture intraoculari ( cristallino, retina, nervo ottico, ecc.).
Successivamente il tessuto asportato viene rimpiazzato da un lenticolo corneale di spessore adeguato (300-350 micron), proveniente dalla Banca degli Occhi del Veneto.
Il lenticolo è costituito da un "bottone" di tessuto (diametro 8,5-9 mm) a sua volta formato dagli strati anteriori della cornea del donatore. Esso viene suturato alla cornea del ricevente; la sutura è generalmente rimossa a distanza di alcuni mesi dall'intervento.
Al termine dell'intervento l'occhio viene bendato; il bendaggio è mantenuto fin quando la cornea del donatore non è completamente riepitelizzata (dai 3 ai 5 giorni sono di solito sufficienti).
torna al menù
Cheratoplastica perforante
Indicazioni
Nella maggior parte dei casi la cheratoplastica perforante si rende necessaria perché la cornea ha perso la sua originale trasparenza (come si verifica in numerose patologie dell'occhio), oppure per il progredire di un cheratocono, che ha determinato l'insorgenza di un astigmatismo non più correggibile con i mezzi tradizionali (occhiali e/o lenti a contatto).In una ridotta percentuale di casi la necessità di un trapianto nasce dal pericolo di una perforazione corneale; in tale evenienza l'obiettivo primario dell'intervento diventa la salvaguardia dell'integrità anatomica del bulbo oculare, mentre le finalità ottiche passano in secondo piano.
In ordine di frequenza le indicazioni più comuni sono la cheratopatia bollosa (pseudofachica, afachica e conseguente a distrofia endoteliale di Fuchs), il cheratocono, il fallimento di precedenti trapianti di cornea, gli esiti cicatriziali da cheratiti infettive (da virus, batteri, Acanthamoeba, ecc.), da traumi, da ustioni e causticazioni.
Provenienza e selezione delle cornee
Le cornee vengono ordinate alla Banca degli Occhi di Monaco di Baviera, Germania (Hornahautbank Munchen), che provvede al controllo della loro qualità secondo gli standard della EBAA (= Eye Bank Association of America). Questi includono lo studio alla lampada a fessura ed al microscopio endoteliale e, per ogni donatore, una serie di esami tesi ad escludere precedenti infezioni da HIV, virus dell'epatite B e C, sifilide, citomegalovirus, virus di Epstein-Barr e toxoplasmosi.Come si svolge l'intervento
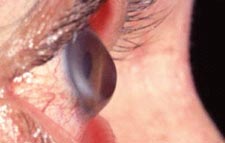
 L'intervento può essere effettuato in anestesia locale o generale; la scelta viene concordata tra il
chirurgo ed il paziente.
L'intervento può essere effettuato in anestesia locale o generale; la scelta viene concordata tra il
chirurgo ed il paziente.L'intervento prevede dapprima l'asportazione a tutto spessore della parte centrale della cornea malata, quindi il posizionamento e la sutura di quella proveniente dal donatore; il diametro dell'incisione sulla cornea ricevente e quello della cornea del dontatore sono preventivamente stabiliti in base alle esigenze del caso.
Il tutto richiede in media 45 minuti.
Al termine l'occhio viene bendato.
Nella foto a destra si può osservare la cornea già trapiantata con la sutura "a stella" in sede.
Il decorso postoperatorio
La rapidità di esecuzione e la scarsa invasività dell'intervento consentono lo svolgimento di questo
tipo di chirurgia in regime ambulatoriale o di day surgery, senza la necessità di ricovero.
In caso di anestesia locale, il paziente viene dimesso dopo meno di un'ora dal termine dell'intervento.
Qualora,invece, si sia fatto ricorso all'anestesia generale, viene tenuto sotto osservazione fino a sera (in ogni caso la notte viene trascorsa a casa).
Il bendaggio è mantenuto da 3 a 5 giorni, fin quando la cornea trapiantata non è completamente riepitelizzata.
Sono prescritte colliri contenenti un antibiotico e cortisone per alcune settimane (il cortisone in collirio spesso viene lasciato per alcuni mesi).
Qualora vi sia un aumentato rischio di rigetto, il chirurgo può prescrivere la somministrazione di farmaci immunosoppressori.
In caso di anestesia locale, il paziente viene dimesso dopo meno di un'ora dal termine dell'intervento.
Qualora,invece, si sia fatto ricorso all'anestesia generale, viene tenuto sotto osservazione fino a sera (in ogni caso la notte viene trascorsa a casa).
Il bendaggio è mantenuto da 3 a 5 giorni, fin quando la cornea trapiantata non è completamente riepitelizzata.
Sono prescritte colliri contenenti un antibiotico e cortisone per alcune settimane (il cortisone in collirio spesso viene lasciato per alcuni mesi).
Qualora vi sia un aumentato rischio di rigetto, il chirurgo può prescrivere la somministrazione di farmaci immunosoppressori.
Quali precauzioni devono essere prese dopo l'intervento?
Si deve prestare la massima attenzione nell'evitare traumi all'occhio.
E' inoltre opportuno nelle prime settimane non dormire sul lato dell'occhio operato.
E' inoltre opportuno nelle prime settimane non dormire sul lato dell'occhio operato.
Come avviene il recupero visivo?
Il trapianto di cornea consente di recuperare quella quota di vista persa a causa dell'opacizzazione della cornea stessa.Il recupero visivo sarà soltanto parziale qualora si associno altre patologie oculari, quali:
- malattie della retina ( degenerazione maculare senile, retinopatia diabetica, retinite pigmentosa, ecc.)
- malattie del nervo ottico (glaucoma, ecc.)
Durante il decorso postoperatorio il recupero visivo è condizionato dalla presenza dei punti di sutura, che vengono lasciati in sede per almeno un anno.
I punti determinano una deformazione corneale responsabile di un astigmatismo, che si riduce solo al momento dell'asportazione della sutura.
Talora può essere opportuno eseguire una redistribuzione della sutura a distanza di 2 o 3 mesi dall'intervento per ridurre l'astigmatismo. Qualora una quota di astigmatismo permanga anche dopo l'asportazione dei punti, si può ricorrere ad una correzione ottica (con occhiali, lenti a contatto o mediante chirurgia).
torna al menù
Cheratite
Da Wikipedia, l'enciclopedia liberaLa cheratite è un'infiammazione della cornea, lo strato più esterno del bulbo oculare a contatto con l'aria.
Si manifesta con dolori e vasodilatazione sulla membrana congiuntiva (i sintomi sono simili a quelli della congiuntivite).
Si può verificare offuscamento della vista.
Tipologie
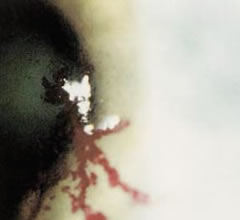 Si distinguono le "cheratiti superficiali" che, dopo la guarigione, non lasciano cicatrici, da quelle
"profonde", che possono invece danneggiare la vista se prossime all'asse visivo.
Si distinguono le "cheratiti superficiali" che, dopo la guarigione, non lasciano cicatrici, da quelle
"profonde", che possono invece danneggiare la vista se prossime all'asse visivo.Anche l'ulcera corneale è un tipo di cheratite.
Quei tipi di cheratiti dovuti ad esposizione eccessiva a raggi ultravioletti sono dette fotocheratiti.
Tra queste c'è la cecità da neve, malattia tipica delle regioni artiche, che deve il suo nome alla sua causa (riverbero della neve senza protezione e per periodi prolungati).
Si distinguono inoltre infiammazioni:
non suppurative:
suppurative
marginali
Cause
Esistono cheratiti dovute ad "amebe", quali l'acanthamoeba, che possono essere contratte da chi usa
lenti a contatto.
Altre cause sono quella virale dovuta agli "herpes simplex" e "zoster", quella batterica dallo staphylococcus aureus o dovute a funghi come il fusarium.
Altre cause sono quella virale dovuta agli "herpes simplex" e "zoster", quella batterica dallo staphylococcus aureus o dovute a funghi come il fusarium.
Diagnosi e cura
La cheratite Herpetica stromale è un evento patologico grave non sempre facilmente controllabile mediante le terapie
disponibili, soprattutto se la diagnosi non viene fatta tempestivamente e la terapia non viene attuata immediatamente.
Nelle forme herpetiche stromali tipiche l'infiammazione è distribuita irregolarmente nello stroma corneale ed è spesso accompagnata da un'uveite.
Una sovrastante cheratite epiteliale può essere presente o meno. Invece si manifesta spesso un edema dell'epitelio (con micro e macro bolle).
Le cellule infiammatorie infiltrano lo stroma a tutti i livelli e possono essere presenti aree di necrosi.
Il processo si può estendere dalla membrana di Bowmann a quella di Descemet (strati della cornea).
L'endotelio può essere interessato da edema, infiltrazione di cellule infiammatorie e, talvolta, al di sotto della lesione stromale è visibile un'essudazione fibrinosa.
Precipitati sono spesso visibili. A livello dell'umor acqueo si apprezza un "Tyndall plasmatico e cellulare" (materie circolanti all'interno del bulbo oculare).
A livello dell'angolo si ha spesso un edema delle bande trabeculari, con un fenomeno di trabeculite che spiega l'associazione non infrequente di ipertono nei pazienti malati.
Fenomeni di interessamento dell'iride e del corpo ciliare sono spesso frequenti, anche se è abbastanza raro che lascino segni riconoscibili clinicamente (aree di atrofia iridea). "Sinechie posteriori" possono essere individuate a causa del processo infiammatorio.
La cheratite stromale è frequentemente associata alla presenza di un'ulcera epiteliale che coinvolge lo stroma. Queste ulcere, se la loro patogenesi non è diagnosticata prontamente e in modo corretto, possono presentare bordi necrotici ed approfondirsi fino alla perforazione.
Il virus dell'herpes simplex è associato a diverse classi di antigeni:
Sebbene siano state individuate saltuariamente delle particelle virali nello stroma degli occhi affetti da cheratite Herpetica, nella maggior parte dei casi la malattia stromale ha le caratteristiche tipiche di un processo immune piuttosto che quelle di una infezione.
Gli infiltrati, infatti, appaiono composti principalmente da macrofagi e linfociti. Nei casi di cheratite herpetica stromale necrotizzante si suppone invece che i due fenomeni infettivo ed immune siano presenti allo stesso tempo.
Studi recenti hanno rilevato sequenze di DNA herpetico in cornee umane che non avevano mai avuto fenomeni clinici riferibili a malattie herpetiche, suggerendo che una infezione herpetica latente può essere presente a livello dell'endotelio e dei cheratociti, senza segni clinici.
I LATs Durante lo stato di infezione latente il virus dell'Herpes non è inattivo, ma produce costantemente RNA virale chiamato "Latency Associated Transcripts" (LATs).
Quando è in questo stato latente non si possono isolare particelle virali se non si praticano esami di colture cellulari espiantate.
I LATs possono invece essere utili marcatori della presenza di una infezione herpetica in corso di infezione latente. Si sospetta inoltre che i LATs possano giocare un ruolo nella riattivazione della replicazione virale.
La presenza di uno stato di infezione latente a livello corneale potrebbe consentire una riattivazione ed una replicazione locale del virus, senza necessità di una riattivazione a livello del ganglio.
Dati recenti mostrano inoltre che l'infezione latente si può localizzare a livello delle cellule endoteliali e dei cheratociti ed essere il punto di partenza di una infezione herpetica stromale.
Alcuni ceppi di Herpes inoltre sembrano mostrare una certa tendenza a dare luogo alla localizzazione stromale della malattia.
Nelle forme herpetiche stromali tipiche l'infiammazione è distribuita irregolarmente nello stroma corneale ed è spesso accompagnata da un'uveite.
Una sovrastante cheratite epiteliale può essere presente o meno. Invece si manifesta spesso un edema dell'epitelio (con micro e macro bolle).
Le cellule infiammatorie infiltrano lo stroma a tutti i livelli e possono essere presenti aree di necrosi.
Il processo si può estendere dalla membrana di Bowmann a quella di Descemet (strati della cornea).
L'endotelio può essere interessato da edema, infiltrazione di cellule infiammatorie e, talvolta, al di sotto della lesione stromale è visibile un'essudazione fibrinosa.
Precipitati sono spesso visibili. A livello dell'umor acqueo si apprezza un "Tyndall plasmatico e cellulare" (materie circolanti all'interno del bulbo oculare).
A livello dell'angolo si ha spesso un edema delle bande trabeculari, con un fenomeno di trabeculite che spiega l'associazione non infrequente di ipertono nei pazienti malati.
Fenomeni di interessamento dell'iride e del corpo ciliare sono spesso frequenti, anche se è abbastanza raro che lascino segni riconoscibili clinicamente (aree di atrofia iridea). "Sinechie posteriori" possono essere individuate a causa del processo infiammatorio.
La cheratite stromale è frequentemente associata alla presenza di un'ulcera epiteliale che coinvolge lo stroma. Queste ulcere, se la loro patogenesi non è diagnosticata prontamente e in modo corretto, possono presentare bordi necrotici ed approfondirsi fino alla perforazione.
Il virus dell'herpes simplex è associato a diverse classi di antigeni:
- Antigeni solubili rilasciati dalle cellule infettate lisate;
- Antigeni aderenti alla superficie delle cellule infette;
- Antigeni formati da larghe proteine insolubili derivate dal capside virale.
Sebbene siano state individuate saltuariamente delle particelle virali nello stroma degli occhi affetti da cheratite Herpetica, nella maggior parte dei casi la malattia stromale ha le caratteristiche tipiche di un processo immune piuttosto che quelle di una infezione.
Gli infiltrati, infatti, appaiono composti principalmente da macrofagi e linfociti. Nei casi di cheratite herpetica stromale necrotizzante si suppone invece che i due fenomeni infettivo ed immune siano presenti allo stesso tempo.
Studi recenti hanno rilevato sequenze di DNA herpetico in cornee umane che non avevano mai avuto fenomeni clinici riferibili a malattie herpetiche, suggerendo che una infezione herpetica latente può essere presente a livello dell'endotelio e dei cheratociti, senza segni clinici.
I LATs Durante lo stato di infezione latente il virus dell'Herpes non è inattivo, ma produce costantemente RNA virale chiamato "Latency Associated Transcripts" (LATs).
Quando è in questo stato latente non si possono isolare particelle virali se non si praticano esami di colture cellulari espiantate.
I LATs possono invece essere utili marcatori della presenza di una infezione herpetica in corso di infezione latente. Si sospetta inoltre che i LATs possano giocare un ruolo nella riattivazione della replicazione virale.
La presenza di uno stato di infezione latente a livello corneale potrebbe consentire una riattivazione ed una replicazione locale del virus, senza necessità di una riattivazione a livello del ganglio.
Dati recenti mostrano inoltre che l'infezione latente si può localizzare a livello delle cellule endoteliali e dei cheratociti ed essere il punto di partenza di una infezione herpetica stromale.
Alcuni ceppi di Herpes inoltre sembrano mostrare una certa tendenza a dare luogo alla localizzazione stromale della malattia.
Presentazioni cliniche della cheratite
La maggior parte dei pazienti affetti da una cheratite herpetica stromale presenta una anamnesi positiva per cheratite
herpetica dendritica epiteliale.
Qualche volta con un congruo intervallo di tempo tra un fenomeno e l'altro, talvolta in successione senza momenti di reale guarigione. In alcuni soggetti tuttavia, il quadro parte primitivamente come stromale.
Altre volte ancora una cheratite epiteliale segue ad una infezione ad esordio primitivo stromale.
La comparsa di un coinvolgimento stromale rappresenta comunque il passaggio ad uno stadio molto più grave della malattia, capace di compromettere permanentemente la visione.
I sintomi, a parte l'offuscamento visivo, sono del tutto aspecifici. Indolenzimento e lacrimazione sono i più frequenti, spesso difficili da interpretare se visti in uno sfondo di alterazioni strutturali della cornea, sofferenza endoteliale, uveite e pressione oculare elevata.
In alcuni casi vi è predominanza di fenomeni di infiltrazione infiammatoria ed edema stromale, mentre in altri il quadro è prevalentemente quello della neovascolarizzazione e dei fenomeni cicatriziali.
Una cicatrice biancastra è di solito il risultato di questa cheratite e dal momento che il suo trattamento spesso richiede una terapia steroidea è bene che sia clinicamente differenziata da un infiltrato infiammatorio.
Talvolta la formazione della cicatrice è preceduta da un assottigliamento o da un ispessimento dello stroma. All'interno della cicatrice si osservano spesso depositi lipidici giallastri o cristallini che possono estendersi quale conseguenza dello stato di leakage dei neovasi.
Se vi è il rischio che la estensione degli essudati possa peggiorare la trasparenza della zona centrale della cornea, producendo un peggioramento della visione, può essere utile tentare la chiusura dei vasi afferenti con il laser ad argon (eseguita sotto copertura antivirale ed antiinfiammatoria).
I risultati sono spesso discutibili.
Qualche volta con un congruo intervallo di tempo tra un fenomeno e l'altro, talvolta in successione senza momenti di reale guarigione. In alcuni soggetti tuttavia, il quadro parte primitivamente come stromale.
Altre volte ancora una cheratite epiteliale segue ad una infezione ad esordio primitivo stromale.
La comparsa di un coinvolgimento stromale rappresenta comunque il passaggio ad uno stadio molto più grave della malattia, capace di compromettere permanentemente la visione.
I sintomi, a parte l'offuscamento visivo, sono del tutto aspecifici. Indolenzimento e lacrimazione sono i più frequenti, spesso difficili da interpretare se visti in uno sfondo di alterazioni strutturali della cornea, sofferenza endoteliale, uveite e pressione oculare elevata.
In alcuni casi vi è predominanza di fenomeni di infiltrazione infiammatoria ed edema stromale, mentre in altri il quadro è prevalentemente quello della neovascolarizzazione e dei fenomeni cicatriziali.
Una cicatrice biancastra è di solito il risultato di questa cheratite e dal momento che il suo trattamento spesso richiede una terapia steroidea è bene che sia clinicamente differenziata da un infiltrato infiammatorio.
Talvolta la formazione della cicatrice è preceduta da un assottigliamento o da un ispessimento dello stroma. All'interno della cicatrice si osservano spesso depositi lipidici giallastri o cristallini che possono estendersi quale conseguenza dello stato di leakage dei neovasi.
Se vi è il rischio che la estensione degli essudati possa peggiorare la trasparenza della zona centrale della cornea, producendo un peggioramento della visione, può essere utile tentare la chiusura dei vasi afferenti con il laser ad argon (eseguita sotto copertura antivirale ed antiinfiammatoria).
I risultati sono spesso discutibili.
La cheratite interstiziale
In questa forma è presente una infiltrazione stromale in presenza di un epitelio intatto.L'infiltrazione può svilupparsi in chiazze singole o multiple e coinvolgere alcuni strati o tutto lo spessore dello stroma.
L'evoluzione è cronica, di solito indolente e persiste per molti mesi. La caratteristica della mancanza del dolore la fa distinguere tipicamente dalle infiltrazioni presenti nelle infezioni fungine talvolta di aspetto e decorso simile che sono invece caratterizzate da dolore intenso.
Una neovascolarizzazione corneale che si spinge verso questi infiltrati è un reperto classico, che può comparire in ogni momento, sia precoce che tardivo, ed a qualsiasi livello di profondità dello stroma.
I vasi sono circondati da un tessuto granulare di infiltrazione. Quando l'infiammazione cessa, questo tessuto granulare scompare ed i vasi possono apparire privi di sangue. La ricanalizzazione di questi vasi è il primo segno della riattivazione del processo infiammatorio.
Questo tipo di infiammazione è ritenuta tipica di una risposta immune tipo antigene/anticorpo mediata dal complemento.
Un edema dello stroma può essere presente, soprattutto in caso di coinvolgimento endoteliale e di solito supera i limiti dell'infiltrazione.
Talvolta l'epitelio presenta una sofferenza diffusa che è possibile sia legata alla infiammazione, alla ipoestesia, alle anomalie lacrimali o alla tossicità dei farmaci utilizzati. Un coinvolgimento dell'endotelio con tutte le conseguenze del caso, è di solito la regola.
Le presentazioni cliniche delle cheratiti herpetiche stromali possono assumere caratteristiche particolari quali, l'anello immune, la vasculite limbare e l'uveite.
L'anello immune
È un anello biancastro completo o più spesso incompleto di infiltrazione che compare alla periferia della cornea, separato dal limbus da uno spazio libero apparentemente indenne, che circonda le lesioni stromali.È presumibilmente il risultato della deposizione di precipitati della reazione antigene anticorpo ed è un chiaro indicatore dello stato di attività della reazione immune.
La vasculite limbare
La vasculite limbare è una reazione iperemica edematosa della cornea, associata alla presenza di un albero di neovascolarizzazione focale che si spinge verso gli infiltrati stromali e che può anche giungere ad interessare due quadranti. Anch'essa rappresenta un segno di attività immune.L' uveite
Una uveite è invariabilmente presente nelle fasi attive anche se difficilmente monitorabile per la presenza delle opacità corneali.Se si associa una trabeculite si ha un innalzamento della pressione oculare.
La cheratite disciforme
È caratterizzata dalla presenza di un'area di edema stromale circoscritta, per lo più localizzata nelle porzioni centrali o paracentrali della cornea, associata ad un risentimento endoteliale, con precipitati cheratici il quadro è indicativo di una reazione immunologica verso le componenti virali o verso cellule endoteliali alterate dalla infezione virale.Normalmente l'epitelio non è interessato, tuttavia quando il deficit endoteliale è marcato o è in atto da molto tempo, si possono formare micro e macrobolle epiteliali con fenomeni ulcerativi dell'epitelio.
Sebbene non chiarita con certezza si ritiene che la presenza attiva del virus possa essere una delle caratteristiche dei quadri di cheratite disciforme in particolare quelli che partono come cherato endotelite e sono caratterizzati da una reazione dell'acqueo, mentre più controversa sarebbe la dimostrazione di virus vitale nei casi a partenza stromale che degenerano in cherato endotelite, nei quali il processo sarebbe prevalentemente immunitario.
Tipicamente si ritiene comunque che il processo infiammatorio nella cheratite disciforme sia cellulo mediato e caratterizzato dalla presenza di linfociti, plasmacellule e leucociti.
Essa può rappresentare quindi il risultato di una reazione immune verso: una infezione virale dell'epitelio, la presenza di DNA virale nello stroma, una infezione virale stromale attiva, la presenza di residui virali antigenici nello stroma.
Sono stati, inoltre, dimostrati elementi antigenici virali nell'endotelio di cornee con cheratite disciforme.
Cheratite stromale necrotizzante
La cheratite stromale necrotizzante si manifesta come una infiltrazione bianco-giallastra nello stroma corneale.L'infiltrazione e la necrosi sono le caratteristiche cliniche predominanti.
Di solito questo tipo di presentazione avviene in cornee precedentemente affette da una cheratite herpetica.
Può essere, quindi, l'evoluzione di una cheratite epiteliale, di una forma stromale disciforme, di una stromale superficiale o di qualsiasi combinazione di forme.
Secondo alcuni i segni clinici che indicherebbero la presenza di virus vitale in Camera Anteriore sarebbero:
- la sofferenza endoteliale
- l'aumento della pressione oculare
- difetti focali a carico del pigmento irideo
- ogni uveite che non risponde agli steroidi
Spesso si forma una ulcerazione dell'epitelio soprastante con edema e neovascolarizzazione.
Una uveite più o meno grave è la regola, talvolta con ipopion e ipertensione oculare.
Una superinfezione batterica o da fungo, così come una perforazione corneale rappresentano possibili complicazioni.
Si ritiene che la cheratite stromale necrotizzante rappresenti una infezione virale diretta dello stroma associata o seguita da una risposta immune.
È quindi evidente che esiste una variabilità nell'aspetto della cornea durante la cheratite herpetica stromale ed è indispensabile saper riconoscere dall'aspetto della presentazione il livello di attività del processo e quindi il rischio per il paziente.
Così una cheratite stromale superficiale e in assenza di neovascolarizzazione rappresenta un fenomeno relativamente leggero mentre una infiltrazione a tutto spessore associata ad una uveite è un fenomeno che rappresenta un considerevole rischio per la salute dell'occhio.
Terapia delle cheratiti herpetiche stromali
Il trattamento della malattia stromale e della cheratite disciforme è molto complesso e talvolta richiede procedimenti chirurgici quale la cheratoplastica perforante che tuttavia ha in questa patologia una percentuale di successi a lungo termine assai più bassa della media.La somministrazione di corticosteroidi è un punto molto delicato nella terapia dell'herpes stromale, mentre il loro uso è assolutamente controindicato nella cheratite epiteliale, la terapia con steroidi topici in associazione con gli antivirali è un punto cardine della terapia dell'herpes stromale.
Il presupposto è che è estremamente importante ridurre il più possibile l'infiammazione a livello della cornea, dal momento che l'infiammazione, alterando i rapporti tra le fibre collagene e la matrice può ridurre la trasparenza della struttura.
L'infiammazione nell'herpes stromale ha origini immmunologiche ed è quindi logico combatterla con sistemi immunodepressivi.
Gli steroidi possono modificare la risposta immune in modi differenti:
- applicati topicamente, inibendo la chemiotassi e limitando la degranulazione dei polimorfo nucleati, possono in qualche modo limitare la produzione locale di anticorpi
- sembrano avere una azione maggiore sulle risposte da ipersensibilità mediate da anticorpi umorali che su quelle cellulo-mediate, anche se si conosce, comunque, una capacità di distruggere i linfociti sensibilizzati. Gli steroidi sono in realtà associati ad una quantità di complicazioni che devono essere tenute presenti ogni qualvolta si prospetta la loro utilizzazione in una cheratite herpetica.
- Aumentano la replicazione virale nelle cellule dell'epitelio.
- La dimostrazione di virus replicanti anche nello stroma corneale suggerisce che gli steroidi possano aumentare
la replicazione virale anche nel corso di cheratiti stromali.
Il problema non è ancora chiarito e l'uso degli steroidi deve essere comunque anche in queste forme attuato con attenzione. - L'uso topico di steroidi può consentire l'instaurazione di infezioni secondarie da batteri e funghi.
- L'aumento della pressione oculare non è raro nei pazienti che sono steroid responder.
La formazione di cataratte sottocapsulari posteriori è una complicazione di ogni terapia steroidea topica prolungata.
L'effetto rimbalzo con una ripresa della infiammazione è quasi costantemente osservabile nel caso gli steroidi vengano ridotti o sospesi troppo bruscamente.
Talvolta può essere un fatto molto grave responsabile di fenomeni di perforazione corneale, sembrerebbe che si abbia una iperproduzione di anticorpi verso gli antigeni dell'herpes. Ciò nondimeno, anche se pericolosa potenzialmente in mani inesperte, la terapia steroidea è un tempo fondamentale dell'approccio alla cheratite stromale herpetica, ed il fattore di rischio non sembra essere tanto la somministrazione degli steroidi, ma la loro cattiva gestione e lo scarso monitoraggio del paziente.
Nelle infezioni epiteliali vi è molto spesso un coinvolgimento dello stroma anteriore, in cui si apprezza un edema del tessuto nella regione sottostante la membrana di Bowman, qualche zona di necrosi ed una infiltrazione di cellule infiammatorie, per lo più leucociti.
Normalmente questo tipo di coinvolgimento stromale lascia opacità minime, ma può residuare una irregolarità della superficie corneale che può permanere anche mesi. Se è possibile, tuttavia, è opportuno astenersi dall'utilizzare cortisone in queste forme, dal momento che nei soggetti che hanno usato cortisone nel trattamento della forma epiteliale si osserva una più facile conversione a malattia herpetica stromale.
Il Vaccino per la cheratite
Una proposta interessante è la possibilità di utilizzare vaccini nel tentativo di ridurre la frequenza e la aggressività delle recidive, sebbene questi vaccini siano sul mercato da diverso tempo, con report di impressioni cliniche anche molto favorevoli, mancano ancora i risultati di un trial clinico affidabile che ne confermino la reale attività.torna al menù
Abrasioni corneali
Di Fabio De Feo e Michele Iester - Clinica oculistica, Università di Genova
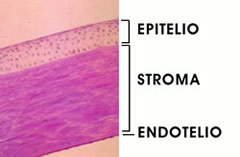
Anatomicamente la cornea si divide in 5 strati: l'epitelio che è la parte più esterna,
la membrana di Bowman che si trova sotto lo strato epiteliale, lo stroma che è la parte centrale
e più spessa della cornea,la membrana di Descemet e l'endotelio che sono i
due strati più interni della cornea stessa.
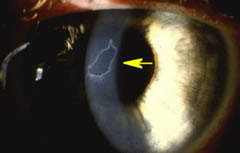 Per abrasione corneale, si definisce la perdita di cellule dell'epitelio corneale attraverso un trauma diretto o indiretto,
lasciando la membrana di Bowman intatta.
Per abrasione corneale, si definisce la perdita di cellule dell'epitelio corneale attraverso un trauma diretto o indiretto,
lasciando la membrana di Bowman intatta.
Tra le più comuni cause di abrasione corneale si possono menzionare i traumi determinati da: unghiate, matite, fogli di carta e pagine di giornali, rami o foglie di piante, strumenti per il trucco.
In alcuni casi la causa del trauma può rimanere all'interno dell'occhio (come ad esempio la polvere dei calcinaci) ed in particolare sotto la palpebra superiore.
In tali circostanze si rilevano tipiche abrasioni multiple ad andamento verticale nella parte centrale e superiore della cornea che altro non sono che lo sfregamento del corpo estraneo sulla cornea ad ogni ammiccamento.
Inoltre una perdita di cellule epiteliali si può verificare in seguito all'esposizione a raggi ultraviletti, come si può verificare dopo una lampada abbronzante o in alta montagna senza occhiali.
Tale patologia viene definita come cheratite attinica.
I pazienti con un'abrasione corneale giungono alla attenzione del medico oculista lamentando dolore, sensazione di corpo estraneo, lacrimazione, fotofobia e, in rari casi in cui vi sia un coinvolgimento della porzione centrale della cornea, lieve diminuzione dell'acuità visiva con sensazione di annebbiamento.
Una riduzione del visus può essere secondario anche alla presenza di un abbondante film lacrimale.
La maggior parte dei soggetti è in grado solitamente di descrivere tempi e modalità del trauma che ha causato l'abrasione stessa.
Fanno eccezione i casi dovuti all'uso eccessivo delle lenti a contatto o a cheratite da ultraviletti (cheratite attinica), in cui la sintomatologia può presentarsi dopo un periodo di latenza di ore: un classico esempio è quello del saldatore che finisce il suo lavoro e poi dopo qualche ora inizia a lamentare fastidio sempre più intenso fino ad essere insopportabile verso le 3-4 del mattino, ora in cui si presentano al pronto soccorso.
Il dolore associato ad un difetto dell'epitelio corneale, ma in assenza di un pregresso trauma, di un uso prolungato di lenti a contatto o di una esposizione ai raggi ultravioletti eccessiva (es.: lampade autoabbronzanti, forte riverbero dei raggi solaricome sulle piste da sci, ecc.), deve essere considerato un campanello d'allarme di una possibile cheratite herpetica sottostante.
L'esame del paziente, specialmente se molto dolorante, può essere facilitato dall'instillazione di una goccia di anestetico locale.
 Per abrasione corneale, si definisce la perdita di cellule dell'epitelio corneale attraverso un trauma diretto o indiretto,
lasciando la membrana di Bowman intatta.
Per abrasione corneale, si definisce la perdita di cellule dell'epitelio corneale attraverso un trauma diretto o indiretto,
lasciando la membrana di Bowman intatta.Tra le più comuni cause di abrasione corneale si possono menzionare i traumi determinati da: unghiate, matite, fogli di carta e pagine di giornali, rami o foglie di piante, strumenti per il trucco.
In alcuni casi la causa del trauma può rimanere all'interno dell'occhio (come ad esempio la polvere dei calcinaci) ed in particolare sotto la palpebra superiore.
In tali circostanze si rilevano tipiche abrasioni multiple ad andamento verticale nella parte centrale e superiore della cornea che altro non sono che lo sfregamento del corpo estraneo sulla cornea ad ogni ammiccamento.
Inoltre una perdita di cellule epiteliali si può verificare in seguito all'esposizione a raggi ultraviletti, come si può verificare dopo una lampada abbronzante o in alta montagna senza occhiali.
Tale patologia viene definita come cheratite attinica.
I pazienti con un'abrasione corneale giungono alla attenzione del medico oculista lamentando dolore, sensazione di corpo estraneo, lacrimazione, fotofobia e, in rari casi in cui vi sia un coinvolgimento della porzione centrale della cornea, lieve diminuzione dell'acuità visiva con sensazione di annebbiamento.
Una riduzione del visus può essere secondario anche alla presenza di un abbondante film lacrimale.
La maggior parte dei soggetti è in grado solitamente di descrivere tempi e modalità del trauma che ha causato l'abrasione stessa.
Fanno eccezione i casi dovuti all'uso eccessivo delle lenti a contatto o a cheratite da ultraviletti (cheratite attinica), in cui la sintomatologia può presentarsi dopo un periodo di latenza di ore: un classico esempio è quello del saldatore che finisce il suo lavoro e poi dopo qualche ora inizia a lamentare fastidio sempre più intenso fino ad essere insopportabile verso le 3-4 del mattino, ora in cui si presentano al pronto soccorso.
Il dolore associato ad un difetto dell'epitelio corneale, ma in assenza di un pregresso trauma, di un uso prolungato di lenti a contatto o di una esposizione ai raggi ultravioletti eccessiva (es.: lampade autoabbronzanti, forte riverbero dei raggi solaricome sulle piste da sci, ecc.), deve essere considerato un campanello d'allarme di una possibile cheratite herpetica sottostante.
L'esame del paziente, specialmente se molto dolorante, può essere facilitato dall'instillazione di una goccia di anestetico locale.
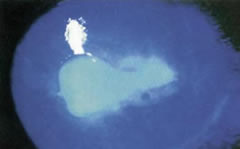 Il difetto epiteliale si può solitamente individuare con facilità usando una lampada a fessura; in ogni caso la lesione risulta
più evidente alla luce blu-cobalto, dopo colorazione della superficie oculare con fluoresceina.
Il difetto epiteliale si può solitamente individuare con facilità usando una lampada a fessura; in ogni caso la lesione risulta
più evidente alla luce blu-cobalto, dopo colorazione della superficie oculare con fluoresceina.Bisogna sempre ricordarsi di esaminare accuratamente la cornea, i fornici congiuntivali e la porzione sottopalpebrale (rovesciando la palpebra superiore), per escludere la presenza di un eventuale corpo estraneo.
Anche se in seguito al trauma subito vi possa essere una minima reazione cellulare in camera anteriore, una reazione significativa deve far pensare ad una infezione corneale o ad un importante trauma oculare (irite traumatica).
Scopo del trattamento delle abrasioni corneali è quello di permettere una rapida riepitelizzazione, prevenendo l'insorgenza di infezioni ed eliminando il dolore che affligge il paziente.
Nonostante sia stato per molti anni la terapia primaria, il bendaggio compressivo dell'occhio affetto non è attualmente considerato così indispensabile come un tempo al fine della guarigione.
Può invece risultare ancora utile nel ridurre il fastidio iniziale provocato dall'azione meccanica delle palpebre sulla lesione durante l'ammiccamento in alcuni pazienti.
Va comunque evitato in caso di infezione.
Se non si evidenziano segni di una concomitante infezione corneale, si può somministrare un antibiotico topico a scopo profilattico.
Se invece esiste il sospetto di un'infezione, è necessario somministrare un antibiotico ad ampio spettro con maggior frequenza e per un periodo più prolungato.
Il paziente dovrebbe poi sottoporsi ad una visita di controllo dopo 24-36 ore, per accertarsi dell'avvenuta riepitelizzazione ed escludere la presenza di un processo infettivo in atto.
In caso di dolore consistente, si può instillare una goccia di collirio cicloplegico (es.: ciclopentolato, tropicamide,..), ed eventualmente prescrivere un antinfiammatorio non steroideo topico per alleviare la sintomatologia, anche se questo si rende raramente necessario.
Esiste il rischio, seppur raro, che il paziente sviluppi erosioni corneali recidivanti, con un riaccendersi periodico della sintomatologia, tipicamente al risveglio.
Abrasione corneale, la benda sull'occhio non serve
A cura de Il Pensiero Scientifico Editore 21/04/2006Non serve la benda oculare dopo un'abrasione della cornea, si può guarirne anche più rapidamente senza coprire l'occhio con la benda, e senza nessuna differenza in termini di dolore provato.
È quanto emerso da un'indagine condotta da Angus Turner del Royal Victorian Eye and Ear Hospital in East Melbourne, Australia basata sulla revisione di 11 sperimentazioni cliniche randomizzate per un totale di 1014 pazienti.
Secondo quanto riferito sulla pubblicazione The Cochrane Library, della organizzazione internazionale no-profit Cochrane Collaboration.
Il risultato è importante perché soprattutto presso le strutture di pronto soccorso vi è ancora la tendenza a bendare l'occhio del paziente cui è stata diagnosticata un'abrasione corneale.
Questa è una piccola lesione dell'epitelio corneale che ci si può procurare in vario modo, per esempio indossando lenti a contatto o se un corpo estraneo penetra nell'occhio. L'abrasione può risultare anche molto dolorosa e si tratta con antinfiammatori per uso locale in gocce e talvolta anche con un collirio per azzerare il rischio di infezione.
L'abrasione corneale, tuttavia, non è un incidente da trascurare perché se non trattata con appropriatezza può anche portare a un'ulcera corneale che è una ferita più grave della cornea e va trattata con antibiotici. L'abitudine a bendare l'occhio di un paziente con abrasione della cornea è ancora radicata ma inutile, anzi può risultare controproducente per la guarigione, è emerso dallo studio.
Infatti gli oftalmologi australiani hanno rilevato che senza benda l'occhio guarisce più in fretta, non aumenta il rischio infezioni che, anzi, possono meglio essere scongiurate perché senza benda l'occhio è a vista.
Inoltre non vi è differenza di dolore con o senza benda.
"Le abrasioni corneali normalmente non influenzano la visione in modo considerevole, quindi è del tutto inutile rendere il paziente monoculare in attesa guariscano", ha affermato Turner. "Perciò è ragionevole concludere che il bendaggio è inutile per il trattamento di semplici abrasioni corneali traumatiche", ha osservato Turner il quale sta iniziando uno studio analogo per vedere se il bendaggio è una pratica appropriata per abrasioni molto estese (più di 10 millimetri quadrati).
Distrofie Corneali Ereditarie
a cura di Ospedali riuniti di TriesteLe distrofie corneali sono un gruppo di disturbi progressivi, solitamente bilaterali, in gran parte geneticamente determinati, di natura non infiammatoria, che causano opacizzazione.
Sono caratterizzate da un'alterazione morfofunzionale conseguente a modificazioni del normale trofismo corneale. L'età di presentazione varia dalla prima alla quarta decade, in relazione alla relativa frequenza di erosioni epiteliali ricorrenti e al deficit visivo.
Le distrofie corneali sono classificate, in base all'aspetto biomicroscopico e istopatologico, in epiteliali, della membrana di Bowman, stromali e endoteliali. I recenti progressi della genetica molecolare hanno identificato i difetti genetici responsabili della maggior parte di queste distrofie.
Distrofie epiteliali
Sinonimi
- Distrofia di Cogan
- Distrofia della membrana basale epiteliale
- Distrofia corneale anteriore
- Distrofia map dot and fingerprint
Cos'è
La distrofia epiteliale microcistica di Cogan è una comune alterazione bilaterale, a livello della giunzione corneale epiteliale alla membrana basale.Tuttavia, si tratta di una condizione che probabilmente ricorda di più una vera e propria degenerazione della cornea. Si manifesta in almeno il 75% dei pazienti con più di 50 anni ed è più comune nelle donne.
In alcune famiglie è stata trovata una ereditarietà autosomica dominante.
Origini e diffusione
Sono state riportate diverse famiglie in cui è stata documentata una trasmissione autosomica dominante della malattia, con individui affetti sia in età giovanile che adulta; tuttavia in un altro studio è stato documentato che questo tipo di distrofia corneale è presente in circa il 75% delle persone con più di 50 anni di età, quasi a rappresentare una modalità età-dipendente di degenerazione corneale.Certo è che la modalità di trasmissione autosomica dominante non può essere esclusa.
L'esatta incidenza della condizione è sconosciuta. Si tratta di una distrofia corneale anteriore bilaterale, caratterizzata dalla presenza a livello epiteliale di linee grigiastre con andamento a fingerprint, aree irregolari tipo carta geografica con aspetto a vetro smerigliato, piccole alterazioni sferoidali (microcisti) opache all'esame con la lampada a fessura.
E' bene ricordare che nel tempo un quadro spesso si trasforma in un altro e anche la distribuzione della lesione può variare.
La presentazione clinica è variabile e può modificarsi nel tempo. La maggior parte dei pazienti è asintomatica; circa il 10%, a partire dai 30 anni di età, può presentare erosioni corneali ricorrenti che provocano dolore e lacrimazione e possono portare a offuscamento della vista.
Viceversa, il 50% dei pazienti che presentano erosioni corneali idiopatiche ricorrenti sono affetti da distrofia di Cogan. Tale affezione non ha conseguenze né sul benessere della cornea né sulla funzionalità visiva.
Dal punto di vista istopatologico, sono state evidenziate alterazioni variabili nella giunzione dell'epitelio alla membrana basale, quali una membrana basale qualitativamente alterata e quantitativamente ridondante che si accresce nello strato epiteliale e lacune intraepiteliali ripiene di detriti cellulari.
Criteri diagnostici
Esame oculistico mediante l'ausilio della lampada a fessura ed un esame ultrastrutturale della cornea.Istologia
Mostra un ispessimento della membrana basale con deposizione di proteine fibrillari tra la membrana basale e la membrana di Bowman. Si verifica inoltre la scomparsa degli emidesmosomi tra le cellule basali epiteliali, motivo per il quale si manifestano le erosioni corneali ricorrenti.Terapia
La cheratectomia fototerapeutica può essere utile.Tuttavia, pur essendo alta la probabilità di recidivare dopo il trattamento, è possibile con successo il reintervento.
Distrofia di Meesmann
Sinonimi
- Distrofia corneale epiteliale giovanile
- Distrofia corneale ereditaria
Cos'è
La distrofia corneale di Meesmann consiste in un'anomalia dell'epitelio corneale ereditata con modalità dominante, caratterizzata dalla presenza di vescicole chiare a livello dell'epitelio corneale.E' stata descritta anche una possibile forma recessiva.
Origini e diffusione
La distrofia corneale di Meesmann è una malattia a trasmissione autosomica dominante. Sono stati descritti alcuni casi a trasmissione autosomica recessiva.Analisi genetiche molecolari hanno dimostrato mutazioni a carico dei geni K3 e K12, geni della cheratina specifica della cornea.
Malattia rara a prevalenza non conosciuta.
Pur essendo le anomalie dell'epitelio corneale presenti fin dai primi mesi di vita, è nella maggior parte dei casi asintomatica durante l'infanzia. Di solito viene diagnosticata in famiglie in cui sono già noti membri affetti. Più tardivamente il paziente può manifestare una sensazione irritativi dell'occhio.
Altri sintomi, di più raro riscontro, sono la lacrimazione, la fotofobia e il blefarospasmo. La visione è generalmente conservata o solo lievemente diminuita. Le cisti epiteliali appaiono al microscopio come numerose piccole opacità puntiformi chiare, nella zona interpalpebrale della cornea.
Le vescicole appaiono uniformi per dimensioni e forma, e si colorano blandamente con fluoresceina.
Le cisti rappresentano accumuli di materiale cellulare degenerato e di detriti circondati dalle cellule adiacenti.
Criteri diagnostici
La diagnosi rimane clinico-strumentale.Non sono disponibili test genetici. Le mutazioni geniche segnalate vengono ricercate per ora sol nell'ambiente di programmi di ricerca.
Diagnosi differenziale
Si pone con la distrofia corneale ricorrente erosiva.Istologia
Mostra un ispessimento irregolare dell'epitelio corneale con numerose cellule vacuolizzate soprabasali.Terapia
La cheratectomia fototerapeutica con laser a eccimeri può dare buoni risultati nel miglioramento della visione e nella cicatrizzazione delle erosioni corneali ricorrenti nel lungo termine.Distrofia della membrana di Bowman - Distrofia di Reis Bucklers
Sinonimi
- Distrofia corneale di Bowman tipo 1 (o CDB I)
Cos'è
Consiste in una anomalia ereditaria a livello della membrana di Bowman corneale.Origini e diffusione
Inizia nei primi anni di vita ed evolve clinicamente con episodi dolorosi ricorrenti, dovuti a fenomeni di erosione epiteliale fino ad arrivare ad interessare la m. di Bowman.Si osservano delle opacità bianco-grigiastre nella m. di Bowman, fini, rotonde o poligonali, più dense al centro. Successivamente la densità delle opacità aumenta con l'età, conferendo alla cornea un aspetto reticolare dovuto alla deposizione di bande irregolari di collagene che sostituiscono la membrana di Bowman.
La cicatrice di queste lesioni a livello della membrana di Bowman provoca un opacizzazione corneale con aspetto a carta geografica.
La sensibilità corneale è ridotta.
L'epitelio mostra fenomeni di degenerazione e atrofia. Sembrano essere delle varianti della distrofia di Reis-Bucklers, le distrofie corneali di Grayson-Willbrandt e Stoker-Holt. Quest'ultima, è caratterizzata dalla presenza di evidenti piccole opacità puntiformi grigie tra epitelio e membrana di Bowman.
L'epitelio è irregolare mentre la membrana di Bowman è indenne; la sensibilità corneale è ridotta.
Si tratta di una malattia genetica a trasmissione autosomica dominante, con il locus del gene su 5q31.
Criteri diagnostici
La diagnosi rimane clinica e strumentale. Non esiste al momento un test genetico di conferma diagnostica.Diagnosi differenziale
Si pone con la distrofia di Thiel-BehnkeIstologia
L'aspetto istopatologico mostra che il nuovo collagene si colora in blu con la colorazione tricromica di Masson e la membrana di Bowman non è visibile oppure è assente.Terapia
Si basa prevalentemente sulla cheratectomia con laser a eccimeri. Talora, può essere necessaria la cheratoplastica lamellare, ma è associata ad una elevata incidenza di recidiva di distrofia nel lembo, che si può sviluppare rapidamente.Distrofia di Thiel-Behnke
Sinonimi
- Distrofia corneale di Bowman tipo 2 (o CDB II)
- Distrofia a favo
- Distrofia di Waardenburg e Jonkers
Cos'è
Si tratta di un'alterazione distrofica ereditaria a carico della membrana di Bowman.Origini e diffusione
Si tratta di una distrofia che interessa l'epitelio corneale e la membrana di Bowman. A differenza della distrofia di Reis-Bucklers, l'esordio della malattia avviene verso la fine della prima decade ed evolve clinicamente con episodi dolorosi ricorrenti, dovuti a fenomeni di erosione epiteliale.Per quanto concerne i segni sono simili a quelli descritti per la distrofia di Reis-Bucklers a eccezione del fatto che le opacità assumono prevalentemente un aspetto ad alveare.
Criteri diagnostici
Mediante l'ausilio della lampada a fessura e di un esame ultrastrutturale corneale.Istologia
L'aspetto istopatologico è simile a quello descritto per la distrofia di Reis-Bucklers.Terapia
Il trattamento può non essere necessario, poiché il deficit visivo solitamente è minore rispetto alla distrofia di Reis-Bucklers.Distrofia centrale (cristallina) di Schnyder
Cos'è
Trattasi di una distrofia corneale ereditaria che interessa la membrana di Bowman e gli strati più superficiali dello stroma corneale.Origini e diffusione
L'esordio avviene alla nascita o nella prima infanzia con deficit visivo, caratterizzato soprattutto da abbagliamento. L'esatta incidenza della condizione è sconosciuta.Si manifesta con la comparsa di opacità "cristalline" subepiteliali scintillanti, di forma rotondeggiante, nell'ambito di una cornea diffusamente opaca, localizzate in sede centro-paracentrale.
Sono interessati gli strati superficiali dello stroma e la membrana di Bowman. L'ereditarietà è AD, con il locus del gene su 1p36-p34.1.
Criteri diagnostici
Mediante l'ausilio della lampada a fessura e di un esame ultrastrutturale della cornea.Istologia
Istologicamente si evidenziano cristalli aghiformi di colesterolo e fosfolipidi che si accumulano per un difetto locale del metabolismo lipidico. Compaiono in genere durante l'adolescenza e non comportano gravi alterazioni dell'acuità visiva.Terapia
E' spesso necessario un trattamento con cheratectomia con laser a eccimeri.Distrofia corneale reticolare
Sinonimi
- Amiloidosi corneale
- Distrofia tipo lattice
Cos'è
La distrofia corneale reticolare è una malattia a trasmissione autosomica dominante, che consiste nella deposizione di amiloide nello stroma corneale e negli spazi subepiteliali, configurando il caratteristico quadro di piccoli accumuli sferoidali uniti da un reticolato di linee.Ne derivano erosioni corneali e un deterioramento progressivo dell'acuità visiva. Da un punto di vista genetico, si possono distinguere due tipi: il tipo I, senza il coinvolgimento di ulteriori tessuti e organi, e il tipo II, associato a una amiloidosi sistemica.
Un'altra classificazione si basa sul quadro clinico e in tal caso la distrofia reticolata viene distinta in:
- Distrofia reticolata tipo I (Biber-Haab-Dimmer)
- Distrofia reticolata tipo II (Sindrome di Meretoja)
- Distrofia reticolata tipo III e IIIA
Distrofia reticolata tipo I (Biber-Haab-Dimmer)
Ereditarietà
Autosomica dominante (AD), con il locus del gene su 5q31Origini e diffusione
Avviene verso la fine della prima decade con erosioni ricorrenti che precedono i cambiamenti tipici dello stroma. E'pertanto possibile che, inizialmente, sfugga alla dignosi.Si verifica la comparsa di macchioline biancastre di forma rotondeggiante nello stroma anteriore che successivamente vanno incontro ad una progressione e coalescenza in fini linee, simili a una tela di ragno, ramificate che formano un reticolato, meglio visibili con la retroilluminazione.
Inoltre, si verifica una diffusione profonda e verso l'esterno che risparmia la periferia corneale. L'opacizzazione generalizzata conduce a un progressivo deficit visivo e può talora mascherare le fini linee reticolate.
Istologia
Mostra sostanza amiloide che colora con rosso Congo, presenta metacromasia con viola cristallino e birifrangenza attraverso polaroid.Terapia
E' spesso necessario un trattamento con cheratoplastica perforante o lamellare prima della sesta decade.Distrofia reticolata tipo II (Sindrome di Meretoja)
Ereditarietà
AD, con il locus del gene su 9q34Origini e diffusione
Avviene nella mezza età con paralisi faciale progressiva e coinvolgimento corneale. Le erosioni ricorrenti sono meno frequenti rispetto alla reticolata tipo 1.Le linee reticolate sono fini, corte, disseminate in maniera casuale.
Inoltre, sono più rade e delicate, con un orientamento più radiale rispetto alla distrofia reticolata tipo 1. Le manifestazioni sistemiche comprendono la neuropatia bilaterale progressiva cronica e periferica, disartria, cute secca ed estremamente molle e pruriginosa, un'espressione caratteristica del volto "a maschera", labbra protrudenti e orecchie pendule. L'amiloidosi può anche coinvolgere reni e cuore.
Istologia
Mostra depositi di amiloide nello stroma corneale e negli altri distretti coinvolti.Trattamento
Avviene mediante cheratoplastica lamellare o perforante; può essere necessario nella settima decade, ma è correlato all'insorgenza di complicanze quali infezioni ricorrenti conseguenti alla cheratopatia da esposizione.Distrofia reticolata tipo III e IIIA
Ereditarietà
Si presume sia autosomico-recessivo (AR), mentre quella del tipo 3A è AD con il locus del gene su 5q31 per entrambe.Origini e diffusione
Avviene tra la quarta e la sesta decade con deficit visivo, ma le erosioni ricorrenti sono poco comuni.Si apprezzano linee spesse e filamentose che si estendono da limbus a limbus intervallate da una minima opacizzazione. Vi può essere una grossolana asimmetria oppure le lesioni possono essere una grossolana monolaterali e comparire saltuariamente.
La progressione è rapida se la cornea è sottoposta a traumi, anche se minimi.
Trattamento
Con la cheratoplastica lamellare o perforante è inevitabile.Distrofia di Avellino
Sinonimi
- Distrofia granulare-lattice della cornea
- Distrofia combinata granulare-reticolare della cornea
Cos'è
Distrofia corneale caratterizzata da alterazioni istopatologiche tipiche della distrofia granulare che di quella reticolare. Dal punto di vista clinico si riscontrano: depositi stremali anteriori bianco-grigiastri; lesioni reticolari dello stroma; opacità stremali.Origini e diffusione
E' una malattia rara a prevalenza non nota.Maschi e femmine sono affetti in eguale misura.
Si caratterizza per tre segni fondamentali: depositi stromali anteriori bianco-grigiastri; lesioni reticolari situate nello stroma medio fino a quello posteriore; opacità stremali anteriori.
Dal punto di vista istopatologico sono presenti le lesioni caratteristiche sia della distrofia granulare che di quella reticolare. Nella distrofia granulare si ritrovano opacità multiple bilaterali, progressive, centrali, anteriori, abitualmente grigie e/o bianche.
La forma di tali opacità è ben definita e può essere a disco, ciambella, clava, nodulare, puntiforme. Nella distrofia reticolare si osservano nella zona centrale della cornea opacità lineari fini che formano un fitto reticolato e opacità nodulari che rendono torbido lo stroma.
In questa forma combinata le lesioni sono di diametro maggiore che nella forma tipo lattice isolata. L'esordio della malattia è nel giovane adulto.
In genere il deficit dell'acuità visiva si verifica tra la terza e la quinta decade di vita. E' una malattia genetica a trasmissione autosomica dominante.
E' bene ricordare che la distrofia di Avellino, reticolata tipo I e granulare, sono correlate a un singolo locus del cromosoma 5q e possono quindi rappresentare forme cliniche diverse di un medesima entità.
Criteri diagnostici
La diagnosi rimane clinica e strumentale. Non esiste al momento un test genetico di conferma diagnostica.Terapia
E' indicata la cheratoplastica perforante negli stadi tardivi, ma sono possibili recidive.Distrofia corneale granulare
Sinonimi
- Distrofia corneale di Groenouw tipo I
Cos'è
Trattasi di una malattia corneale caratterizzata dalla presenza di piccole opacità biancastre a livello dello stroma corneale anteriore assiale visibili alla lampada a fessura.Origini e diffusione
La malattia è rara a prevalenza non nota.Maschi e femmine sono affetti in ugual misura.
L'esordio della malattia è nel giovane adulto; si evidenziano piccoli depositi biancastri, ben delimitati che ricordano i fiocchi di neve o le briciole, centralmente nello stroma anteriore. Le lesioni sono multiple, progressive e bilaterali. La forma di tali opacità è ben definita e possono assumere forma a disco, ciambella, nodulare, clava, puntiforme.
La graduale confluenza è causa di deficit visivo ed in genere tale deficit si verifica tra la terza e la quinta decade di vita. La cornea periferica solitamente non è coinvolta.
Possono verificarsi anche se non molto frequentemente ricorrenti lesioni epiteliali dolorose con secondarie opacizzazioni e vascolarizzazioni.
Criteri diagnostici
La diagnosi rimane clinica e strumentale. Non esiste al momento un test di conferma diagnostica.Istologia
Mostra depositi ialini amorfi che colorano in rosso brillante con il tricromo Masson.Terapia
Cheratoplastica lamellare o occasionalmente penetrante, a seconda della profondità della opacità stromale.Distrofia Corneale Maculare
Sinonimi
- Distrofia corneale di Groenouw tipo II
- Distrofia corneale di Fehr
- Distrofia corneale spottiforme
Cos'è
Rappresenta la distrofia stromale corneale meno comune in cui l'errore congenito sistemico del metabolismo del cheraton solfato ha solo manifestazioni corneali.E' stata suddivisa nei tipi I, IA e II, a seconda della presenza o assenza del cheraton solfato antigenico (aKS) nel siero e nella cornea, sebbene la morfologia corneale sia identica.
Origini e diffusione
Malattia rara a prevalenza non conosciuta; in alcune comunità la prevalenza raggiunge 1 su 500 abitanti. L'esordio della malattia è fra i 5 e 9 anni, con riscontro con riscontro di aree di opacità di densità variabile, progressive, bilaterali dello stroma corneale, che si estendono dalla membrana di Bowman alla membrana di Descemet e da lembo a lembo.La sensibilità corneale può essere ridotta e si possono verificare erosioni corneali ricorrenti che provocano fotofobia ed episodi di dolore.
Lo stroma corneale è più sottile che nella norma.
L'acuità visiva si riduce significativamente dalla quarta decade di vita, a causa dell'eventuale confluire delle opacità corneali e dell'eventuale coinvolgimento a tutto spessore dello stroma fino al limbus.
La malattia è ereditaria a trasmissione autosomica recessiva.
Criteri diagnostici
La diagnosi è clinica e strumentale. Non sono disponibili test genetici.Istologia
Mostra accumuli di collagene, ravvicinati in modo anormale a livello delle lamelle corneali, e un' anomala aggregazione dei glicosaminoglicani che colorano con Alcian blu.Trattamento
La distrofia richiede un intervento di cheratoplastica penetrante.Distrofia gelatinosa a goccia
Sinonimi
- Amiloidosi subepiteliale familiare della cornea
Cos'è
E' una rara distrofia corneale, anch'essa come la distrofia maculare, a trasmissione autosomica recessiva.Origini e diffusione
L'esordio avviene tra la prima e la seconda decade con grave fotofobia, lacrimazione e deficit visivo.Si verificano in ordine di comparsa:
- Noduli grigi subepiteliali
- Graduale confluenza, coinvolgimento stremale e aumento di dimensioni, con un caratteristico aspetto nodoso, simile al gelso.
Criteri diagnostici
La diagnosi è clinica e strumentale. Non sono disponibili test genetici.Istologia
Dall'esame istopatologico si evidenzia l'accumulo di amiloide subepiteliale e nello stroma anteriore.Terapia
Si basa sulla cheratectomia con laser a eccimeri, spesso ripetuta per la precoce recidiva nei lembi corneali.Distrofie endoteliali di Fuchs
Sinonimi
- Distrofia corneale endoteliale
Cos'è
La distrofia di Fuchs è una malattia che interessa l'endotelio corneale che si manifesta in età adulta e più raramente in infanzia/adolescenza.Di regola il coinvolgimento oculare è bilaterale, ma in rari casi può essere unilaterale. Dal punto di vista clinico la distrofia è caratterizzata da un edema corneale.
Origini e diffusione
Colpisce prevalentemente il sesso femminile.I maschi hanno una probabilità tre volte minore di sviluppare la malattia.
Si riscontra in genere verso i 50 anni di età, ma può esordire anche durante l'adolescenza. Il difetto fondamentale è un progressivo deterioramento dell'endotelio corneale.
Le cellule endoteliali negli adulti, nel tentativo di sostituire funzionalmente le cellule che vanno incontro a deterioramento, danno luogo ad un ispessimento della membrana di Descemet sia localizzato che diffuso, con progressiva degenerazione e disfunzione dell'endotelio. Si evidenzia quindi un edema a esordio dal centro e secondaria diffusione alla periferia.
Con il progredire dell'edema stremale, il sollevamento microbolloso dell'epitelio provoca una riduzione dell'acuità visiva ed esordisce la cheratopatia bollosa.
L'acuità visiva rimane normale durante le fasi iniziali dell'edema, ma successivamente si può verificare un calo transitorio di questa, per opacizzazione centrale della cornea.
Il difetto visivo è più significativo alla mattina a causa della ridotta osmolalità delle lacrime secondaria a diminuita evaporazione delle lacrime durante il sonno e migliora gradualmente durante il giorno.
L'evidenzia istologica di una funzione anomala della cellula endoteliale è presente molti anni prima che compaiono i segni clinici della cornea guttata e dell'ispessimento della membrana di Descemet.
Nella distrofia di Fuchs si possono distinguere tre stadi in base all'ordine di comparsa dei segni patognomonici della patologia corneale:
- Stadio 1: è caratterizzato dal graduale aumento della guttata centrale con diffusione periferica e confluenza, conferendoun aspetto a "metallo battuto".
- Stadio 2: è caratterizzato da scompenso endoteliale che ha come esito un edema stremale centrale, con annebbiamento visivo che si riduce durante l'arco della giornata. L'edema epiteliale si manifesta quando lo spessore corneale è aumentato del 30% circa.
- Stadio 3: è caratterizzato da edema epiteliale persistente e ha come esito la formazione di bolle (cheratopatia bollosa) che causano dolore e fastidio al momento della rottura, a causa dell'esposizione delle terminazioni nervose denudate. Sopraggiungono poi la sostituzione della membrana di Bowman da parte di un panno degenerativo e la graduale opacizzazione dello stroma. Da un punto di vista eziopatogenetico è considerata una distrofia a trasmissione autosomica dominante con penetranza incompleta.
Criteri diagnostici
I primi segni clinici della distrofia di Fuchs sono le gutte lungo la membrana di Descemet e i granuli di pigmento adesi alle cellule endoteliali.Le gutte corneali, seppur asintomatiche, sono evidenti all'esame biomicroscopico. Nei pazienti con sospetta distrofia di Fuchs la pressione intraoculare così come l'integrità corneale dovrebbero essere assolutamente monitorate.
Diagnosi differenziale
Si pone verso le altre forme di distrofia corneale, che in genere si rendono clinicamente manifeste in età più giovane (seconda decade); sono tipicamente bilaterali e simmetriche, mentre la distrofia di Fuchs comporta spesso un interessamento asimmetrico.Terapia
- L'ipertonicità del film lacrimale può essere ottenuta mediante l'ausilio di colliri a base di cloruro di sodio al 5% o pomate. Questi metodi possono essere utili per disidratare la cornea e ridurre quindi l'edema corneale.
- La lente a contatto terapeutica garantisce sollievo proteggendo le terminazioni nervose esposte ed appiattendo le bolle.
- La cheratoplastica perforante ha un elevato tasso di successo e non deve essere ritardata.
- Altre opzioni in occhi con un potenzialità funzionale scarsa includono il ricoprimento congiuntivale e l'innesto di membrana amniotica.
Distrofia posteriore polimorfa
Cos'è
E' una distrofia rara, non pericolosa e asintomatica in cui le cellule dell'endotelio corneale mostrano caratteristiche simili all'epitelio.L'esordio avviene alla nascita o poco dopo, benche spesso venga diagnosticata per caso più tardi nel corso della vita.
Origini e diffusione
La prevalenza non è nota. L'ereditarietà è solitamente autosomica dominante, con il locus del gene sul cromosoma 20. I segni sono minimi, consistono in formazioni endoteliali vescicolari, a banda, o geografiche che possono essere asimmetriche. Si può associare a membrane iridee, sinechie anteriori periferiche, ectropion uveae, corectopia e glaucoma, ricordando una sindrome iridocorneale endoteliale. E' stato pertanto ipotizzato che i due aspetti clinici rappresentino punti di uno spettro della stessa patologia.Vi è anche una associazione con la sindrome di Alport.
Criteri diagnostici
La diagnosi è clinica e strumentale. Non sono disponibili test genetici.Terapia
Il trattamento terapeutico solitamente non è necessario.torna al menù
Cross-linking: centri convenzionati
 Un elenco dettagliato dei centri italiani che offrono il
CROSS-LINKING in convenzione.
Un elenco dettagliato dei centri italiani che offrono il
CROSS-LINKING in convenzione.L'elenco è aggiornato al 30 giugno 2009,per segnalazioni e aggiornamenti scrivere a:
info@associazionecheratocono.it
Regione Abruzzo
L'Aquila
- OSPEDALE SAN SALVATORE via Vetoio 4 - Cap: 67100 - Tel: 0862.3681
Referente: Prof. Leopoldo Spadea - CASA DI CURA PIERANGELI P.za Pierangeli 1 - Cap: 65124 - Tel: 0854.241561
Referente: dr. Aceto - dr. Tarantini
Regione Basilicata
Venosa (Pz)
- PRES. OSPEDALIERO SAN FRANCESCO via Roma 187 - Cap: 85029 - Tel: 0972.39368
Regione Calabria
Cosenza
- CASA DI CURA SANTA LUCIA via Trieste 71 - Cap: 00198 - Tel: 0984.26826
Lamezia Terme (Cz)
- PRES. OSP. LAMEZIA TERME v.le Perugini 71 - Cap: 88046 - Tel: 0968.208868 -
0968.208917 - 0968.208870
Referente: dr. Venosa
Regione Campania
Castellamare di Stabia
- OSPEDALE SAN LEONARDO v.le Europa - Tel: 081.8729111
Napoli
- AZ. OSP. V. MONALDI via L. Bianchi - Cap: 42100 - Tel: 0522.296111
Referente: dr. Venosa
Regione Emilia Romagna
Reggio Emilia
- OSP. SANTA MARIA NUOVA v.le Risorgimento 80 - Cap: 42100 - Tel: 0522.296111
Referente: dr. Avuini
Regione Friuli Venezia Giulia
Pordenone
- OSP. S. MARIA DEGLI ANGELI via Montereale 24 - Cap: 136 - Tel: 06.68361
Referente: d.sa A. Balestrazzi
Regione Lazio
Roma
- DIP. OFT. E RETE TER. p.le degli Eroi 11 - Cap: 33170 - Tel: 0434.399111
Referente: dr. Beltrane - OSP. S. CARLO DI NANCY via Aurelia 275 - Cap: 165 - Tel: 06.39701
Referente: dr. Scipione Rossi
Regione Lombardia
Brescia
- OSPEDALE CIV. DI BRESCIA P.le Osp. Civile 1 - Cap: 25100 - Tel: 030.3702209
Milano
- OSP. MIL. BAGGIO via Saint Bon 7 - Cap: 20147 - Tel: 02.48703182
- CENTRO OSP. Tel: 347.0333903
Referente: dr. Guzzi
Como
- OSP. DI GRAVEDONA via Pelascini 3 - Cap: 22015 - Tel: 034.492111
Meda (Lc)
- CENTRO VISIONE LARIANO piazza Affari 7 - Cap: 23900 - Tel: 0341.353093
Regione Marche
Macerata
- OSP. GEN. PROV. MACERATA via Santa Lucia 2 - Cap: 62100 - Tel: 073.32571
Regione Molise
Larino (Cb)
- OSPEDALE G. VIETRI Via Lualdi 8 - Cap: 86035 - Tel: 0874.827272
Regione Piemonte
Torino
- OSP. OFTALMICO via Juvarra 19 - Tel: 011.5661566
Referente: Prof. De Sanctis
Regione Puglia
Acquaviva (Ba)
- OSP. GEN. REG. MIULLI via Maselli Campagna 106 - Cap: 70021 - Tel: 080.3054929
Cerignola (Fg)
- OSP. CIV. G. TATARELLA via Trinitapoli - Cap: 71042 - Tel: 088.5419687
San Giovanni Rotondo (Fg)
- CASA SOLL. D. SOFFERENZA via Cappuccini 2 - Cap: 71013
Conversano (Ba)
- OSPEDALE DI CONVERSANO L.go Veneziani 31 - Tel: 080.4091206
Regione Sicilia
Ragusa
- AZ. OSP. CIV. M.P. AREZZO P.zza Igea 1 - Cap: 97100 - Tel: 093.2600467
Regione Toscana
Arezzo
- OSPEDALE SAN DONATO via P. Nenni 20 - Cap: 52100 - Tel: 0575.305093
Pisa
- AZ. OSP. UNIV. PISANA Via Zamenhof 1 - Cap: 56100 - Tel: 050.992111
Firenze
- CLINICA OC. CAREGGI Via delle Oblate 1 - Cap: 50141 - Tel: 055.411765
Prato
- OSPEDALE CIVILE V.le Repubblica 240 - Cap: 59100 - Tel: 057.44341
Regione Trentino Alto Adige
Trento
- OSP. S. CHIARA largo Medaglie d'oro 9 - Cap: 38100 - Tel: 0461.903286
Regione Veneto
Conegliano (Tv)
- OSP. DEI GIRONCOLI Via D. Manin 110 - Cap: 31015 - Tel: 0438.654111
Regione Umbria
Perugia
- OSP. S.M. DELLA MIS. P.le Giorgio Menghini 1 - Cap: 06123 - Tel: 075.5781
Referente: Prof. Cagini
torna al menù
Simplifying Ectasia Screening with Pentacam Corneal Tomography
PUBLISHED BY JAYPEE-HIGHLIGHTS IN THE HIGHLIGHTS OF OPHTHALMOLOGY JOURNAL, VOLUME 38, NO. 3, 2010Renato Ambrosio Jr., MD, PhD
 Scarica il pdf
Scarica il pdfThe problem of ectasia after LVC
Since the first report of post-LASIK ectasia by Theo Seiler MD, PhD, in 1996, progressive ectasia emerged as one of the most important complications of laser vision correction (LVC) procedures. Many studies suggest that the rate of new cases of post-LASIK ectasia is declining.However, because LVC represent the most popular elective procedure performed in medicine today and the very severe devastating nature of ectasia, even a very low incidence is perturbing. Ectasia prevention is the most effective strategy.
Refractive surgeons face routinely the challenge to identify cases at higher risk for ectasia. Therefore a proper understanding of this condition is critical.
Simplistically, there are two possible explanations for the development of ectasia: the presence of an ectatic disorder preoperatively and the severe impact of the surgery on the corneal biomechanical structure.
In both situations, there is a process of chronic biomechanical failure of the remaining stromal tissue after the LVC procedure. In post-LASIK ectasia cases, the lamellar cut combined with the laser ablation leads to an unstable remaining residual stromal bed (RSB).
Ectasia can also occur after surface ablation procedures, but the biomechanical impact of the surgery is less pronounced. The ectatic process of the corneal stroma occurs through a 2-step process of delamination and interfibril fracture because of the unsupportive corneal structure to the continuous stresses, which are caused by intraocular (IOP) pressure, extra-ocular muscles action, blinking, eye rubbing and other forces.
The process is characterized clinically by thinning and bulging of the cornea, leading to a myopic shift and irregular astigmatism, reducing uncorrected and best spectacle-corrected visual acuity.
Risk factors for ectasia after LASIK surgery are well recognized in the literature. Preoperative Placido disk-based topographic abnormalities, such as keratoconus or pellucid marginal degeneration, are considered the most important risk factors.
Moreover, the residual stromal bed (RSB) thickness is also important because this portion of the cornea will be responsible for maintaining the biomechanical strength of the cornea following LASIK. RSB is typically calculated by subtracting the LASIK flap thickness and laser ablation from pre-operative central corneal thickness (CCT).
Therefore, thick flaps, higher corrections, re-treatments and thin corneas would be related to lower RSB. An FDA limit of 250µm has been accepted but there are cases with over 300 µm that developed ectasia and also, there are cases with RSB as low as 200 µm that remained stable with long follow up.
An ectasia risk score scale was proposed by Randleman and co-authors. The Randleman’s Risk Score System (RRSS) uses pre-operative central corneal thickness (CCT) measured with the ultrasound, the axial curvature maps of the front corneal surface (Corneal Topography - CT) and the level of correction, in addition to the anticipated RSB and patient’s age.
The RRSS was statistically validated in a second study, where it was determined to have a sensitivity of 92% and specificity of 94%. Therefore, 6% of the cases that developed post-LASIK ectasia were not identified as high risk at the RRSS. In addition, there were 8% of the cases with good outcomes that were classified as at high risk. The incidence of such false positive cases may be as high as 35% if a younger population of LASIK cases is studied. These situations definitively illustrate the current gaps in our knowledge and the need to develop more sensitive and specific diagnostic tests for screening refractive candidates.
Novel enhanced screening criteria based on 3D Corneal Tomography (CTm) and biomechanical analysis was proposed by our group. (Ambrósio Jr R et al. Clinical Evidence of the Enhanced Sensitivity and Specificity of Corneal Tomography and Biomechanics for Screening Ectasia in Refractive Candidates ePoster ASCRS 2009. ascrs2009.abstractsnet.com).
Goals of ectasia screening
Careful preoperative screening is paramount to the success of LVC. Classically, Placido’s CT and CCT have been widely considered as the classical tools that are essential for screening refractive candidates.It is well recognized that CT can detect signs of the disease before definitive symptoms or slit-lamp findings develop. These cases, typically referred as sub-clinical ectasia (or forme fruste) have demonstrated that CT is critical for the preoperative screening.
However, in addition to the false negative cases at the RRSS, there are many reports of ectasia after LASIK, in which no risk factor was identified by CT, CCT and clinical parameters. It is well accepted that such cases have presented with early forms of the disease that were not detectable by CT.
In fact, the detection of the earliest of incipient ectasia or even its susceptibility should be the goal when screening refractive candidates. It is assumed that any cornea may undergo unstable, progress to biomechanical failure and ectasia if the stresses overpass its biomechanical resistance.
There are also false positive cases at the RRSS, along with many reports of good outcomes after LASIK in cases with abnormalities detected at CT. Such mysteries related to ectasia would be solved if the screening process targets for characterizing ectasia susceptibility.
Why corneal tomography?
Considering the importance of Corneal Topography (CT) or computerized videokeratography for the development of Refractive Surgery and the need for evolving in the diagnostic methodology, it is critical to have recognition and adherence to proper terminology.Prof. Steve Klyce, PhD has been commended for his pioneering work and many continuous contributions to this field. Topography derives from Greek words “to place” (topo) and “to write” (graphein), which means to describe a place.
This is classically related to the study of Earth’s surface shape and features or those of planets, moons, and asteroids. CT should be the term used for the evaluation of the corneal anterior surface. Curvature axial or tangential maps, refractive maps, wavefront decomposition and elevation maps of the front (anterior) are possible from topographic data, which is commonly acquired from the Placido’s disc.
However, other technologies such as the raster photogrammetry have been also used for CT.
Tomography also derives from the Greek words “to cut or section” (tomos) and “to write” (graphein). In Medicine, tomography is a method of mathematically calculating three-dimensional structures of a solid organ.
Thereby, Corneal Tomography (CTm) should be used for the diagnostic characterization of the front and back corneal shape, along with pachymetric mapping. Different technologies such as horizontal slit scanning, rotational Scheimpflug, arc scanning with very high frequency ultrasound (VHFUS) and optical coherence tomography (OCT) are available in different commercial instruments.
This article summarizes our current approach using the Pentacam Corneal Tomographer (Oculus Optikgeräte GmbH, Wetzlar, Germany).
UNDERSTANDING PENTACAM CORNEAL TOMOGRAPHY
 The Pentacam is a family of instruments that perform CTm using a rotating Scheimpflug camera that runs 360o.
The Pentacam is a family of instruments that perform CTm using a rotating Scheimpflug camera that runs 360o. The system can be programmed to take 25 or 50 images for the 3-D evaluation (Figure 1). It has been our routine to use 25 pictures since this is a significantly faster approach and there is no difference on the accuracy and on the repeatability of the data acquired (Ambrósio, unpublished data 2005).
Once the patient is positioned on the instrument in a comfortable and aligned position, the examiner positions the camera accordingly to the patient´s eye and asks the patient to blink just and then keep the eyes wide open just before the camera is released. It is advised to use automatic release option for proper centering.
This technique decreases the chances of the patient blinking during the scan. It is also preferred that no drop is applied to the patient´s eye prior to the exam since these may interfere with the tear film and affect the measurements of the cornea.
However, pharmacologic dilation may be used if necessary.
 When the scan is finished, the data is processed and the overview display is presented. The examiner should look at the Scheimpflug images which have indeed very relevant data for clinical interpretation.
When the scan is finished, the data is processed and the overview display is presented. The examiner should look at the Scheimpflug images which have indeed very relevant data for clinical interpretation.Examination quality specification should be checked so that the exam is to be repeated if necessary, accordingly to the results (Figure 2). It is important to note that warning signs such as the 3-D model deviation (yellow) is not necessarily related to a poor exam.
Once the data is properly acquired and this is assured to be of acceptable quality, clinical interpretation would follow.
TYPES OF MAPS, DISPLAYS AND COLOR SCALES
 The Pentacam has developed over the past years a very wide range of possible maps and displays, as well as many different color scales.
The Pentacam has developed over the past years a very wide range of possible maps and displays, as well as many different color scales.
This wide variability of options may sometimes confuse the clinician.
It is relatively common to receive for a second opinion the JPEG image from the Pentacam exam with very poor presentation of the data, which definitively jeopardize clinical interpretation and limits the benefits of the technology.
For practical standpoints, we focus on the evaluation of two or three displays in an organized stepwise fashion: the “Quad (4 Maps) Refractive”, “Belin/Ambrósio Enhanced Ectasia Display” and the “Holladay Report”.
In some cases, the displays “Scheimpflug”, “Topometric”, “Show 2 Exams Topometric”, “Show 2 Exams Pachymetry” and “Zernike Analysis” are also used.
 Any color-coded map would be influenced by the color scale chosen.
Any color-coded map would be influenced by the color scale chosen. The number of colors, the step value between each color, the highest and lowest colors, values and the grading change between each color are the main characteristic to be considered.
Table 1 summarizes the best scales as my personal preference.
In fact, it has been advocated for having a fixed set of color scales for some Displays such as the “4 Maps Refractive” Display.
The Ambrósio2 palette (Figure 3A) of colors was developed, inspired on the benefits and limitations of the Belin Intuitive Scale (3B), the Smolek-Klyce (3C) and the Wilson-Klyce classic scales.
The concept of a wide range of colors was combined with the contrast between the highest color and lower color. This color palette was originally developed for pachymetric maps, considering statistical values found in a study comprising of 226 normal corneas and 88 keratoconic corneas (Ambrósio, Caiado & Bonfadini, unpublished data 2009).
In the normal population, mean thinnest point (TP) value was about 550µm and standard deviation (SD) of 30 µm. The green color was centered on the 550 and the shades of darker and lighter green were calculated to be within 1SD.
The best cut off value in the Receiver operating characteristic (ROC) curve for keratoconus and normals was around 500µm, which was set for the yellow threshold. The TP had a sensitivity of 87% and specificity of 90% (p0.001, Mann– Whitney U test).
Finally, the mean TP was about 450µm for keratoconus corneas, which should be the threshold for the red color. On the thicker side, attention was given to a cohort of 34 corneas with Fuchs’ Endothelial Dystrophy.
 Mean TP value for Fuchs’ corneas and the best cut off value in the ROC curve were 625µm and 600µm, which was set for the green
to blue threshold. The TP had a sensitivity of 82% and specificity of 91% (p0.001, Mann–Whitney U test) for normals versus Fuchs’.
Mean TP value for Fuchs’ corneas and the best cut off value in the ROC curve were 625µm and 600µm, which was set for the green
to blue threshold. The TP had a sensitivity of 82% and specificity of 91% (p0.001, Mann–Whitney U test) for normals versus Fuchs’. The Ambrósio2 pachymetric scale was designed to facilitate the differentiation of normal and pathologic thin and thick corneas because it provides color information regarding the thickness profile.
The distribution of the colors around the TP correlates well with pachymetric distribution graphs (Figure 4) and enables the identification of a normal thin cornea (4A) and one with similar TP value but abnormal profile and keratoconus (4B).
The importance of corneal thickness and pachymetric distribution evaluation were discussed in Vol. 35, issue # 4, 2007 of HIGHLIGHTS OF OPHTHALMOLOGY JOURNAL by Ambrósio, Silva and Simonato.
The color scale also impacts the representation of the curvature map. There has been a long debate on the preference for absolute fixed color bars and powers, such as the Smolek-Klyce scale, versus relative scales with adjustable colors and powers accordingly to the cornea studied, such as the ones found in the “Eye Sys” that are similar to the Holladay Primary (relative 0.5D, 15 Colors: Blue to Red Scale).
There are important advantages for each direction, but generally the adjustable scales are more sensitive and the absolute scales, more specific.
 It has been my preference to routinely use absolute color scales because of the relative facilitation for comparison different maps.
It has been my preference to routinely use absolute color scales because of the relative facilitation for comparison different maps.
The Ambrósio 2 scale also has some interesting features related to its use for sagittal curvature maps (Figure 5). Average and SD is 43.1 +/- 1.43D for central K and 44.6 +/- 3.4D for highest K (KMax) among normals (n=226).
These values are well on the range of green to green-blue. The best cut off value in the ROC curve was around 48D which was set for the orange to red. The KMax had a sensitivity of 97.7% and specificity of 96.9% (p 0.001, Mann–Whitney U test; Ambrósio, Caiado & Bonfadini, unpublished data 2009).
The KMax performs by itself superiorly than the “topometric” KKS (keratoconus score) indices from the Oculus software, which are based on the 8mm front curvature data.
 It has been my preference to routinely use absolute color scales because of the relative facilitation for comparison different maps.
It has been my preference to routinely use absolute color scales because of the relative facilitation for comparison different maps.
The Ambrósio 2 scale also has some interesting features related to its use for sagittal curvature maps (Figure 5). Average and SD is 43.1 +/- 1.43D for central K and 44.6 +/- 3.4D for highest K (KMax) among normals (n=226).
These values are well on the range of green to green-blue. The best cut off value in the ROC curve was around 48D which was set for the orange to red. The KMax had a sensitivity of 97.7% and specificity of 96.9% (p 0.001, Mann–Whitney U test; Ambrósio, Caiado & Bonfadini, unpublished data 2009).
The KMax performs by itself superiorly than the “topometric” KKS (keratoconus score) indices from the Oculus software, which are based on the 8mm front curvature data.
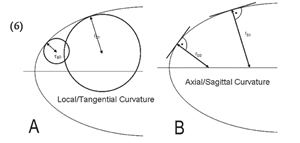 In fact, we found the sensitivity and specificity of the KKS were 94.32% and 87.62% respectively (Guerra, Valbon & Ambrósio, unpublished data 2009).
In fact, we found the sensitivity and specificity of the KKS were 94.32% and 87.62% respectively (Guerra, Valbon & Ambrósio, unpublished data 2009).Regarding curvature maps, it is very important for the clinician to understand the difference from sagittal (or axial) maps and tangential (or instantaneous) maps.
While in the sagittal map, the curvature of the cornea is determined at each measured points at a normal (90°) angle to its surface referenced to the mid-line, tangential maps evaluate the local radius at each measured point of data (Figure 6).
This highlights differences among the measured points and results in a more “noisy” color pattern for the tangential maps (Figure 7).
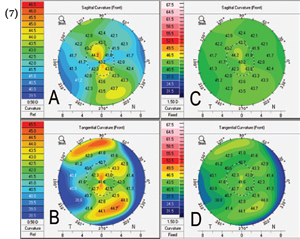 It is important to note that sagittal curvature maps have been more popular for screening refractive candidates. In fact, classic screening systems such as the Rabinowitz-McDonnell were developed based on sagittal or axial maps.
It is important to note that sagittal curvature maps have been more popular for screening refractive candidates. In fact, classic screening systems such as the Rabinowitz-McDonnell were developed based on sagittal or axial maps. These indices are based on the steepness of the cornea, superior-inferior asymmetry and between eyes asymmetries.
The basics and advantages of elevation based topography were discussed by Belin and Khachikian in the Book “Elevation Based Topography-Screen-ing for Refractive Surgery” published by HIGHLIGHTS OF OPHTHALMOLOGY JOURNAL in 2008.
It is important that the examiner understands that the elevation maps are in fact differential maps from the examined corneal surface and reference that was chosen. Thereby the reference would severely impact any elevation maps.
For practical purposes, we have chosen to use the central 8mm of the cornea for the calculation of the reference curve, which can be the best fit sphere (BFS) or toric ellipsoid (BFTE). The elevation maps from the front and back surfaces of the cornea should be evaluated for their pattern and elevation values in corneal landmarks: apex and thinnest.
In a study comprising of 100 normal corneas (50 patients) and 60 keratoconic corneas (30 patients), the ROC curves for posterior elevation values at the thinnest point considering either BFS or BFTE performed better than at the apex, but with similar performances.
Best cut offs were 21 and 13 for the BFS and BFTE, with area under the ROC (AUROC) 0.98 and 0.97 respectively (Canedo, Louzada, Belin & Ambrósio, unpublished data 2009).
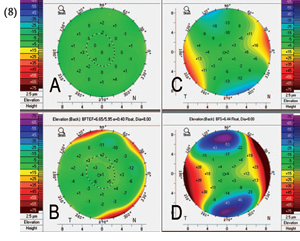 Thereby, either BFS or BFTE perform well for diagnosing keratoconus if we consider the elevation at the thinnest point and the
8mm zone.
Thereby, either BFS or BFTE perform well for diagnosing keratoconus if we consider the elevation at the thinnest point and the
8mm zone. Interestingly, these different approaches provide additional complementary information about the regularity of the astigmatism and optical quality (Figure 8).
The Pentacam provides a very detailed corneal thickness distribution map with accuracy and repeatability within less than 3µm. From this data, the Corneal Thickness Spatial Profile (CTSP) and the Percentage Thickness Increase (PTI) graphs are calculated.
A pachymetric progression index (PPI) is also calculated for every one degree meridian along the complete 360o, starting at the thinnest point. The average of all meridians and the one with lower and higher values are presented. In a normal population, the averages and SD of PPI of the minimal, maximal meridians and average of all meridians are 0.58 +/- 0.3, 0.85 +/- 0.18 and 0.13 +/- 0.33.
The pachymetric index will be higher if the cornea gets thicker in a more accentuated pattern from the thinnest point out to the periphery (PTI and CTSP graphs falling down). Interestingly, the best parameters we have ever developed for diagnosing keratoconus are the ones related to the “Ambrósio Relational Thinnest”, which is the thinnest pachymetric value divided by the pachymetric progression.
The “Ambrósio Relational Thinnest” is thereby calculated for the, minimal (ART-Min) average (ART-Mid) and maximal (ARTMax). The “ART” concept combines thinnest with the pachymetric distribution, which facilitates the identification of an abnormal cornea despite its thinnest value. The ART-Mid and ART-Max have AUROC of 0.98 and 0.99, with cut offs of 426µm and 339µm, respectively (Ambrósio, Guerra, Caiado and Belin, unpublished data 2010).
For practical standpoints, we have adopted not to perform LASIK if ART-Max is lower than 400µm.
The Belin/Ambrosio Enhanced Ectasia Display (BAD) was discussed by Belin, Khachikian, Salomão and Ambrósio in Vol. 35 No. 6, 2007 HIGHLIGHTS OF OPHTHALMOLOGY JOURNAL. The goal of the BAD was to combine elevation based and pachymetric corneal evaluation in one comprehensive display to give the clinician a global view of the tomographic structure of the cornea.
Deviation of normality values were implemented for the front and back enhanced elevations, pachymetric distribution and vertical displacement of the thinnest in relation to the apex.
The final D was developed for having lower than 5% of false positives and false negatives. The relevance of the BAD was determined in a study of eyes with highly asymmetric keratoconus, in which it was confirmed the superior sensitivity of the display over front surface curvature and central thickness evaluation.
The combination of the new elevation based approach and the pachymetric distribution has increased sensitivity to more than 90% in corneas with normal curvature maps from patients previously diagnosed with “unilateral keratoconus” (Salomão and Ambrósio, unpublished data 2007) as seen in the example (Figures 9, 10 and 11).
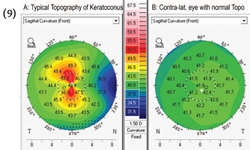
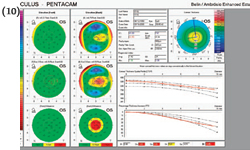
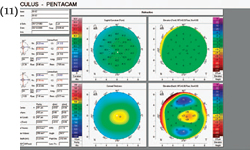
|
conclusion
Screening ectasia is a critical issue for contemporary Ophthalmology practice. The tremendous evolution from keratometry to corneal topography has continued into tomography. Careful attention for the color scale choice should be taken. Elevation maps should be referenced to the BFS or BFTE for the 8mm area.The values at the thinnest point provide the most reproducible parameter. The ART (Ambrósio Relational Thinnest) provides a novel combined parameter that combines the thickness and pachymetric distribution. New displays such as the BAD, provide a comprehensive refractive surgical screening tool to assist the refractive surgeon in identifying those patients at risk for post-operative ectasia.
However, clinicians should be alert to evaluate every individual case in detail for proper identification and staging of keratoconus and related disorders. New treatments, such as collagen crosslinking and intracorneal ring segments should be indicated and planned based on a conjunction of corneal topography, tomography and wavefront data.
Biomechanical characterization is a new area for corneal propedeutics which opens a new dimension for understanding the ectasia susceptibility for each individual cornea.
torna al menù

 Diagnosi Hi-Tech del cheratocono: il ruolo dell’epitelio corneale di Amedeo Lucente
Diagnosi Hi-Tech del cheratocono: il ruolo dell’epitelio corneale di Amedeo Lucente
