Retinopatia diabetica il diabete dell'occhio
- Il diabete Mellito
- La retinopatia diabetica
- La retinopatia diabetica - SOI Società Oftalmologia Italiana
- Linee Guida
- Linee guida retinopatia diabetica (ppt)
- Müller Cells as Players in Retinal Edema
- Prevenzione della Retinopatia Diabetica
- Trattamento della Retinopatia diabetica
- Diabetic Macular Edema
- Macular Edema
- Applying Ultra-Widefield angiography in diabetes and other inflammatory diseases.
- Optical Coherence Tomography for Diabetic Macular Edema: Early Diagnosis, Classification and Quantitative Assessment
- Diabetic Retinopathy (from The New England Juornal of Medicine)
- Diabetic Retinopathy Guidelines
- Diabetic Retinopathy Screening (DRS) and the Ophthalmology Clinic set up in England
- Eye Diseases: Diabetic Retinopathy
- The clinical utility of ultra-wide-field imaging.
- Understanding Diabetic Retinopathy
Leggi anche : la chirurgia della retina
La retinopatia diabetica
eyeproject.com
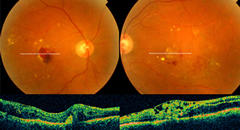 La retinopatia diabetica rappresenta la più comune complicanza indotta dal diabete a livello oculare.
La retinopatia diabetica rappresenta la più comune complicanza indotta dal diabete a livello oculare. Essa colpisce circa il 20% dei pazienti affetti da diabete mellito.
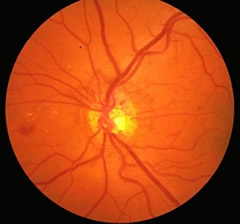
Ne esistono due forme principali: La prima, denominata retinopatia non proliferante, rappresenta la fase iniziale della malattia.
E' caratterizzata da un'aumenta fragilità delle pareti dei vasi (possibile causa di emorragie retiniche) e da una loro alterata permeabilità, che può determinare la fuoriuscita patologica (essudazione) di liquidi e materiale proteico e/o lipidico provenienti dal sangue.
Il paziente può notare una riduzione della vista se le emorragie ed i fenomeni di alterata permeabilità dei vasi interessano la macula.
L'accumulo di liquidi nella macula (edema maculare) è la più comune causa di riduzione visiva nella retinopatia diabetica.
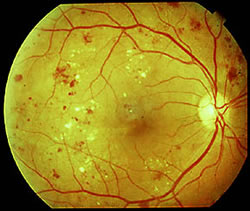 Segni tipici che l'oculista può osservare
all'esame del fondo
in questa fase sono microaneurismi, emorragie ed essudati (duri e/o molli).
Segni tipici che l'oculista può osservare
all'esame del fondo
in questa fase sono microaneurismi, emorragie ed essudati (duri e/o molli).Il secondo tipo di retinopatia diabetica è definito proliferante e rappresenta una fase più avanzata della malattia.
Essa è caratterizzata dalla proliferazione di nuovi vasi all'interno dell'occhio; lo stimolo a tale proliferazione è rappresentato dalla non perfusione (o ischemia) di estese aree di retina, conseguente all'occlusione dei capillari e dei vasi di piccolo calibro.
I vasi neoformati tendono a sanguinare con maggiore facilità.
La prima volta che si verifica un sanguinamento, i sintomi possono essere rappresentati solo dalla visione di qualche macchia scura, che entro pochi giorni si riassorbe; spesso tuttavia le emorragie aumentano d'intensità e determinano una perdita visiva sempre maggiore, che in molti casi non regredisce.
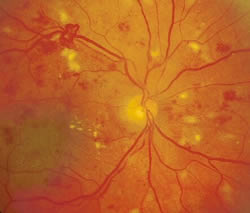 Inoltre i neovasi possono esercitare una trazione sulla
retina e provocarne il distacco.
Inoltre i neovasi possono esercitare una trazione sulla
retina e provocarne il distacco.Le conseguenze terminali della retinopatia diabetica non trattata sono devastanti (distacco di retina, glaucoma neovascolare, ecc.) e possono condurre alla cecità.
Poiché, soprattutto nelle fasi iniziali della malattia, il paziente può godere ancora di un'ottima vista pur essendo già affetto dalla retinopatia diabetica, è importante sottoporsi alla visita di un oculista.
Questi può stabilire la presenza o meno di alterazioni retiniche; i dati della visita possono essere integrati dallo studio della circolazione corioretinica mediante la fluorangiografia.
Ulteriori informazioni possono essere fornite dall'OCT.
Il diabete Mellito
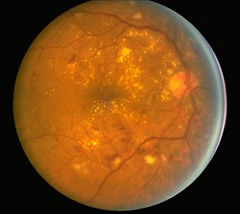 Il diabete mellito è una patologia caratterizzata dall'aumento della concentrazione di uno zucchero -il glucosio- nel sangue (iperglicemia).
Il diabete mellito è una patologia caratterizzata dall'aumento della concentrazione di uno zucchero -il glucosio- nel sangue (iperglicemia). Nonostante sia stato dimostrato che fattori genetici, ambientali, alimentari, autoimmuni ed infettivi giochino un ruolo nello sviluppo di questa malattia, le cause che portano all'alterazione dei meccanismi che regolano la concentrazione del glucosio nel sangue non sono ancora completamente note.
Esistono due forme principali di diabete mellito.
La prima è chiamata diabete di tipo I o insulino-dipendente: tipicamente inizia in età giovanile e spesso richiede l'insulina come terapia (l'insulina è un ormone che in condizioni fisiologiche il nostro organismo produce con il pancreas per abbassare i livelli di glucosio nel sangue).
La seconda variante è chiamata diabete di tipo II o insulino-indipendente; nella sua patogenesi un ruolo scatenante è giocato spesso da un'alimentazione eccessiva e ricca di zuccheri (tale variante è infatti nota anche come "diabete alimentare").
Le persone affette da questa patologia hanno un'età generalmente superiore ai 40 anni e, nella maggior parte dei casi, sono in grado di controllare la glicemia con la dieta (gli alimenti da ridurre o evitare sono lo zucchero, i dolci, il pane, la pasta, gli alcolici e la frutta) o con farmaci per via orale (ipoglicemizzanti orali).
Elevati livelli di glucosio nel sangue possono danneggiare numerosi organi, tra i quali anche l'occhio (retinopatia diabetica).
Purtroppo a tutt'oggi non esistono possibilità di guarigione né per il diabete né per la retinopatia diabetica.
Prevenzione della Retinopatia Diabetica
La retinopatia tende ad aggravarsi in rapporto alla durata del diabete ed al riscontro di livelli elevati
di glucosio nel sangue.
Il controllo della glicemia riduce il rischio e ritarda la progressione della retinopatia diabetica.
E' fondamentale collaborare con il diabetologo per stabilire e seguire un appropriato piano di trattamento, che includa dieta ed esercizio fisico, per controllare i livelli di glucosio nel sangue.
Il controllo della glicemia riduce il rischio e ritarda la progressione della retinopatia diabetica.
E' fondamentale collaborare con il diabetologo per stabilire e seguire un appropriato piano di trattamento, che includa dieta ed esercizio fisico, per controllare i livelli di glucosio nel sangue.
Frequenza delle visite oculistiche
 Ogni paziente al di sotto dei 30 anni dovrebbe essere visitato da un oculista entro un anno dalla diagnosi iniziale
di diabete.
Ogni paziente al di sotto dei 30 anni dovrebbe essere visitato da un oculista entro un anno dalla diagnosi iniziale
di diabete. Dopo i 30 anni la prima visita oculistica dovrebbe essere effettuata al momento della diagnosi.
Le visite successive dovrebbero essere effettuate almeno una volta all'anno.
Tale intervallo potrebbe essere significativamente ridotto a seconda della gravità della malattia.
Dal momento che la gravidanza può peggiorare l'evoluzione della retinopatia diabetica, è necessario che le pazienti diabetiche si sottopongano ad un controllo oculistico all'inizio della gravidanza e, successivamente, ogni tre mesi.
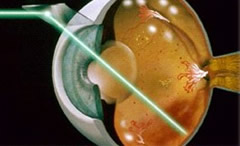
Trattamento della retinopatia diabetica
 Esistono due forme di trattamento per la retinopatia diabetica: il laser e la chirurgia (vitrectomia).
Esistono due forme di trattamento per la retinopatia diabetica: il laser e la chirurgia (vitrectomia).Il laser è una procedura ambulatoriale che viene utilizzata per la terapia dell'edema maculare e per la prevenzione e la terapia della retinopatia proliferante.
Questo studio è attrezzato dal 1984 di Argon Laser per trattare la retinopatia diabetica. Il trattamento laser dell'edema maculare, che riduce le probabilità di futura perdita della vista in circa la metà dei pazienti, viene eseguito con lo scopo di diminuire l'accumulo di liquido nella macula, la regione centrale della retina. Per quanto concerne invece la retinopatia proliferante, si fa ricorso al trattamento laser della periferia retinica (fotocoagulazione panretinica); questo trattamento viene praticato qualora la fluorangiografia riveli la presenza di aree di ischemia retinica (che possono stimolare la proliferazione di neovasi) o in caso di retinopatia proliferante conclamata (per arrestare la crescita dei neovasi); anche questo trattamento, che si svolge in più sedute, riduce il rischio di grave perdita della vista in oltre la metà dei pazienti.
 La vitrectomia è un intervento chirurgico che si rende necessario in caso di:
La vitrectomia è un intervento chirurgico che si rende necessario in caso di:
- retinopatia diabetica proliferante in rapida evoluzione
- emorragie all'interno dell'occhio (emovitreo)
- distacco di retina
Essa consiste nella rimozione del corpo
vitreo (la sostanza gelatinosa che riempie l'occhio) e nella sua
sostituzione con una soluzione salina o - temporaneamente- con olio di silicone. In casi selezionati, l'intervento
di vitrectomia può essere eseguito in
anestesia locale ed in regime ambulatoriale; negli altri casi si può rendere
necessaria l'anestesia generale con ricovero in day surgery.
Tuttavia, nonostante i progressi della medicina moderna, la retinopatia diabetica rimane ancora un serio problema irrisolto, per il quale è richiesta consapevolezza e conoscenza da parte del paziente circa la prognosi: impossibilità della guarigione e spesso progressione della malattia malgrado le terapie appropriate.
Tuttavia, nonostante i progressi della medicina moderna, la retinopatia diabetica rimane ancora un serio problema irrisolto, per il quale è richiesta consapevolezza e conoscenza da parte del paziente circa la prognosi: impossibilità della guarigione e spesso progressione della malattia malgrado le terapie appropriate.
Linee-guida per lo screening, la diagnostica e il trattamento della retinopatia diabetica
a cura di : AMD (Associazione Medici Diabetologi) - ANAAO-ASSOMED (Associazione Medici Dirigenti Consorzio Mario Negri Sud) - FAND-AID (Associazione Italiana Diabetici) - FIMMG (Federazione Italiana Medici di Famiglia Gruppo di Studio Complicanze Oculari della Società Italiana di Diabetologia) - SID (Società Italiana di Diabetologia SIR-Società Italiana della Retina) - SOI-APIMO-AMOI (Società Oftalmologica Italiana Tribunale dei Diritti del Malato)Sommario
La retinopatia diabetica è la più importante complicanza oculare del diabete mellito e costituisce nei paesi industrializzati, la principale causa di cecità legale tra i soggetti in età lavorativa.I sintomi ad essa correlati spesso compaiono tardivamente, quando le lesioni sono già avanzate, e ciò sovente limita l'efficacia del trattamento.
A livello nazionale non esistono ne' dati relativi alla prevalenza ed incidenza della cecità legale (residuo visivo non superiore a 1/20 nell'occhio migliore) nei pazienti diabetici, nè un registro dei soggetti affetti da diabete mellito.
Esistono tuttavia dati epidemiologici da cui emerge che almeno il 30% della popolazione diabetica sia affetto da retinopatia e che annualmente l'1% viene colpito dalle forme gravi della stessa.
I principali fattori di rischio associati alla comparsa più precoce e ad un'evoluzione più rapida della retinopatia sono la durata del diabete, lo scompenso glicometabolico e il cattivo controllo dell'eventuale ipertensione arteriosa concomitante, sia nei pazienti con diabete di tipo 1 che in quelli di tipo 2.
La cecità da retinopatia diabetica potrebbe essere evitata in più della metà dei casi se venissero attuate una corretta informazione dei pazienti e forme adeguate di educazione sanitaria, fondamentali per il successo di qualsiasi politica di prevenzione del danno visivo nel diabete.
Lo screening delle complicanze oculari, con tecniche di dimostrata efficacia e impiegate da personale addestrato, consente di individuare precocemente la retinopatia diabetica ad alto rischio e quindi di prevenire la perdita della vista.
Un registro informatizzato nazionale dei pazienti diabetici permetterebbe di reclutare tutti i cittadini che necessitano di screening e di attuare le adatte procedure di verifica della qualità del programma. Esistono trattamenti molto efficaci per arrestare l'evoluzione della retinopatia.
L'esecuzione tempestiva e corretta della fotocoagulazione laser previene la grave riduzione visiva nei pazienti con retinopatia proliferante e con edema maculare clinicamente significativo.
La chirurgia vitreo-retinica può evitare il grave deficit visivo in alcuni casi di oftalmopatia diabetica avanzata. Negli stadi più avanzati della retinopatia è inoltre possibile ridurre il disagio dovuto all'ipovisione, mediante sistemi ottici per ipovedenti.
I pazienti ed i loro medici curanti dovrebbero essere resi edotti delle possibilità di riabilitazione e delle modalità per ottenerle.
I costi umani, sociali ed economici conseguenti alla retinopatia diabetica richiedono l'immediata applicazione di tutti quei provvedimenti preventivi che hanno già dimostrato la loro efficacia nei paesi in cui sono stati attuati.
Premessa
Le evidenze scientifiche oggi disponibili hanno dimostrato che, mediante programmi di screening e trattamento della retinopatia diabetica (RD), è possibile ridurre drasticamente la cecità da diabete. Nei paesi in cui tali programmi sono già stati applicati, è stata ottenuta una sostanziale riduzione della cecità da diabete, accompagnata da importanti risparmi in termini di economia socio-sanitaria.La RD è infatti la patologia per la cui prevenzione vi è il miglior rapporto costo-beneficio; cioè a fronte di un costo ridotto dell'intervento medico vi è un ottimo risultato per quanto attiene alla qualità di vita del paziente.
In Italia, dove tali programmi non sono applicati su tutto il territorio nazionale sono ancora molti i diabetici nei quali si riscontrano le complicanze più gravi della retinopatia.
Per modificare questa situazione è indispensabile realizzare programmi di informazione rivolti sia ai pazienti che alle varie categorie del personale sanitario coinvolte a vario titolo nella loro assistenza.
A questo scopo è apparso utile che i rappresentanti delle varie categorie sanitarie, insieme a quelli delle associazioni dei pazienti e ad esperti di metodologia producessero queste Linee-Guida che, tenendo conto delle informazioni scientifiche disponibili oggi sull'argomento, fossero applicabili con successo nelle diverse realtà del nostro paese.
Il diabete mellito
Il diabete è una sindrome costituita da malattie metaboliche che hanno come sintomo comune l'iperglicemia.L'attuale classificazione (1) include il tipo 1, dovuto a distruzione delle cellule del pancreas che producono insulina (cellule Beta), e il tipo 2, caratterizzato dalla insufficiente produzione di insulina da parte delle cellule Beta o da un difetto di azione dell'insulina stessa.
Altre forme di diabete sono quelle secondarie ad altre malattie e il diabete che compare in corso di gravidanza (gestazionale).
La prevalenza del diabete in Italia è stimata intorno al 3-4% della popolazione ed aumenta con l'età. Circa un caso su 10 è diabete di tipo 1.
Si stima inoltre che da un terzo a metà dei casi di diabete di tipo 2 già insorto non sia ancora diagnosticato in quanto asintomatico. Le proiezioni dell'Organizzazione Mondiale della Sanità (2) prevedono il raddoppio dei casi di diabete in Europa entro il 2025, a causa dell'aumento dei fattori di rischio quali l'invecchiamento della popolazione, la sedentarietà e le scorrette abitudini alimentari.
Il diabete è causa di complicanze croniche invalidanti che coinvolgono principalmente l'occhio, il rene, il sistema nervoso periferico, ed il sistema cardiocircolatorio.
Il diabete è attualmente la principale causa di cecità in età lavorativa, di insufficienza renale, di amputazioni degli arti inferiori per cause non traumatiche e di rischio triplicato di infarto e di ictus.
E' perciò indispensabile intensificare gli sforzi della ricerca volti a identificare le cause del diabete e delle sue complicanze e mettere in atto fin d'ora tutte quelle misure preventive che si sono già dimostrate utili a ridurre le conseguenze.
A questo fine, rappresentanti dei pazienti diabetici, dei medici e dei governi europei hanno preso formalmente l'impegno di ridurre il carico di morbilità e mortalità del diabete con la Dichiarazione di Saint-Vincent sottoscritta nel 1989 (3).
Epidemiologia e fattori di rischio per la retinopatia diabetica
Studi epidemiologici condotti in alcune aree geografiche concordano nell'indicare che le complicanze oculari del diabete rappresentano la più comune causa di cecità negli adulti in età lavorativa in Italia (4) come in altri paesi industrializzati (5-8).Il deficit visivo nel soggetto diabetico è dovuto nell'80-90% dei casi alla retinopatia.
In Provincia di Torino l'incidenza di cecità secondaria al diabete è di circa 2 casi/100.000 popolazione generale/anno (4).
La retinopatia diabetica è causa del 13% dei casi di grave handicap visivo, comprendendo in questa definizione sia pazienti per legge considerati portatori di cecità parziale (residuo visivo non superiore a 1/20 nell'occhio migliore) e cecità totale (residuo visivo non superiore alla percezione del movimento della mano).
I dati riportati, ottenuti dagli archivi degli Uffici preposti al rilascio delle pensioni di Invalidità Civile, potrebbero essere sottostimati, sia per l'inesattezza dell'attribuzione della diagnosi, sia per mancata registrazione di alcuni casi.
La prevalenza della RD è trascurabile nei giovani con diabete di durata inferiore ai 5 anni ed in età prepuberale.
Quando il diabete è diagnosticato dopo i 30 anni di età, la prevalenza di retinopatia è del 20% dopo 5 anni di malattia, 40-50% dopo 10 anni e oltre il 90% dopo i 20 anni (9,10).
Pertanto, il 30-50% della popolazione diabetica è affetto da retinopatia in forma più o meno grave (11).
L'incidenza di retinopatia in un periodo di osservazione di 4 anni varia dal 34% al 59%, a seconda che si tratti rispettivamente di pazienti anziani trattati con sola dieta o di giovani insulino dipendenti (12,13).
Il controllo metabolico è il più importante dei fattori di rischio modificabili.
E' stato chiaramente dimostrato, mediante studi di intervento, che ottimizzare il controllo metabolico (modificazione dello stile di vita con interventi di educazione sanitaria strutturata, intensificazione del trattamento farmacologico, supporto polispecialistico) ritarda la comparsa e rallenta il peggioramento della retinopatia, sia nei pazienti con diabete tipo 1 (14) che in quelli tipo 2, indipendentemente dal tipo di trattamento ipoglicemizzante seguito (15).
Anche il controllo intensificato dell'ipertensione arteriosa permette di ritardare l'insorgenza e rallentare l'evoluzione della retinopatia (16).
Non sono ancora state chiarite le possibili relazioni esistenti tra fumo di sigaretta, lipidi circolanti e retinopatia.
Oltre alla retinopatia, il diabete è associato ad altre alterazioni oculari.
La cataratta non solo è più frequente ma tende a manifestarsi più precocemente e la sua asportazione chirurgica può avere esiti meno favorevoli per il recupero visivo rispetto alla popolazione non diabetica.
Storia naturale e classificazione della retinopatia diabetica
La RD viene distinta in due forme: la retinopatia non proliferante e la retinopatia proliferante.Tale classificazione, pur nella sua semplicità, ha una base anatomo-patologica (nella retinopatia non proliferante le lesioni sono contenute nell'ambito del tessuto retinico, mentre nella proliferante invadono il corpo vitreo) e consente di tenere distinti quadri clinici con caratteristiche diverse sia dal punto di vista terapeutico che prognostico.
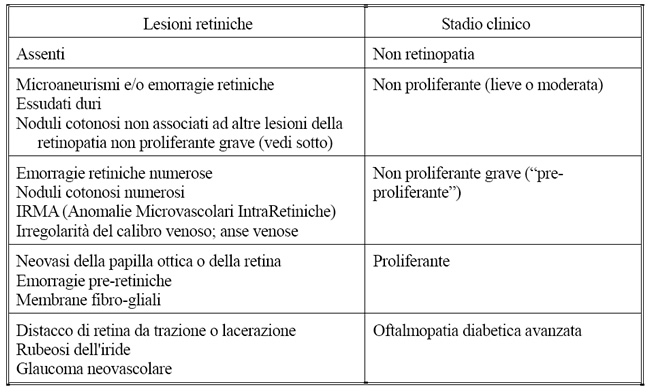
All'osservazione del fondo dell'occhio si possono identificare le seguenti lesioni: microaneurismi, emorragie, essudati duri, noduli cotonosi, anomalie microvascolari intraretiniche (IRMA), irregolarità del calibro venoso, edema retinico e la proliferazione fibrovascolare, la cui comparsa identifica la forma proliferante (Tabelle 1 e 2).
La retinopatia non proliferante viene distinta in tre stadi di crescente gravità: lieve, moderata ed avanzata (o grave o preproliferante) sulla base della presenza e numerosità delle lesioni.
La forma lieve è caratterizzata dalla presenza di rari microaneurismi ed emorragie; l'incremento di tali lesioni, associato alla comparsa di essudati duri, definisce il quadro di modesta gravità; lo stadio non proliferante avanzato è caratterizzato dalla coesistenza di numerosi microaneurismi, noduli cotonosi, emorragie retiniche profonde, anomalie del calibro venoso ed IRMA.
Tali segni oftalmoscopici sono espressione indiretta di fenomeni di danno anatomo-funzionale della parete vasale e di fenomeni di occlusione dei capillari retinici, con conseguente ridotta perfusione di aree retiniche più o meno estese (aree ischemiche).
Tali aree di ipoperfusione causano la liberazione di sostanze angiogene responsabili delle proliferazioni fibrovascolari.
L'identificazione della retinopatia non proliferante avanzata è importante in quanto essa evolve in retinopatia proliferante nel 40% dei casi entro 12 mesi.
La retinopatia proliferante è caratterizzata dallo sviluppo di capillari neoformati (neovasi o neovascolarizzazioni), che rappresentano un tentativo di supplire alla ridotta perfusione retinica.
I neovasi presentano una parete costituita da solo endotelio e, pertanto, sono molto fragili e sanguinano facilmente, causando emorragie pre-retiniche ed endovitreali.
Le neovascolarizzazioni possono essere localizzate sulla retina e/o sulla papilla ottica e si accompagnano ad un'impalcatura fibrosa che prende inserzione sul piano retinico ed all'interno della cavità vitreale.
La contrazione di tale tessuto può essere causa di distacco retinico secondario. Viene definita retinopatia proliferante ad alto rischio, la forma in cui le neovascolarizzazioni hanno grandi dimensioni (>1/3 dell'area papillare) o sono associate a fenomeni di sanguinamento preretinico.
Un'ulteriore temibile conseguenza della ridotta perfusione del tessuto retinico è lo sviluppo di neovasi a livello del segmento anteriore dell'occhio (iride ed angolo della camera anteriore), con conseguente comparsa del glaucoma neovascolare.
Sia la retinopatia non proliferante che la retinopatia proliferante possono essere complicate da un danno della parte centrale della retina, la macula, di tipo edematoso e/o ischemico a cui consegue una grave compromissione delle funzioni visive, in particolare dell'acuità visiva e della percezione dei colori.
Sulla base delle caratteristiche cliniche è stato identificato un quadro a maggior rischio di danno visivo, definito edema maculare clinicamente significativo, caratterizzato da:
- ispessimento della retina entro 500 µm dal centro della macula;
- essudati duri localizzati entro 500 µm dal centro della macula, associati ad ispessimento della retina;
- aree di ispessimento retinico ampie almeno 1 diametro papillare a distanza pari o inferiore ad un diametro papillare dal centro della macula.
(Tab. 1) Classificazione della retinopatia diabetica
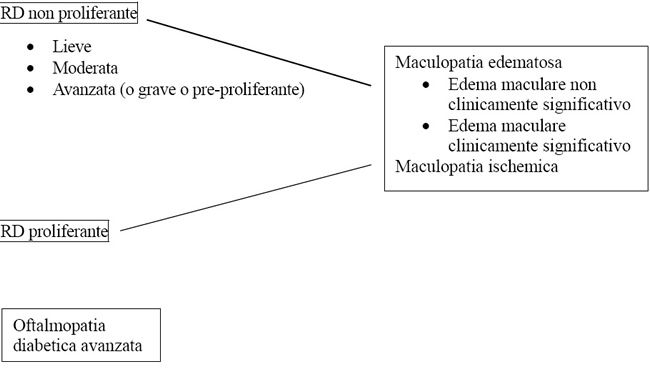
Tab. 2. Identificazione della retinopatia diabetica in base alle lesioni osservabili in oftalmoscopia
Screening della retinopatia diabetica
L'efficacia della terapia in corso di retinopatia diabetica è strettamente correlata alla tempestività della applicazione dell'intervento terapeutico.La sintomatologia soggettiva può essere scarsa o assente anche in presenza di gravi lesioni retiniche, che possono esitare a breve termine in perdita visiva.
Per questo motivo l'adozione di efficaci programmi di screening è l'indispensabile premessa per ridurre i casi di gravi compromissioni visive da diabete.
Per screening si intende una procedura diagnostica semplice, applicata ad un'intera popolazione a rischio, con lo scopo di individuare le lesioni che possono identificare, previo approfondimento diagnostico, i quadri clinici da sottoporre ad idonea terapia.
Lo screening non rappresenta perciò un iter diagnostico completo, ma una metodica per individuare i pazienti che necessitano di ulteriori indagini.
L'esecuzione dello screening della retinopatia diabetica è ampiamente giustificata dai seguenti motivi:
- affronta un problema sanitario importante;
- la storia naturale della retinopatia diabetica è ben nota, in particolare per quanto riguarda gli stadi nei quali è possibile intervenire più efficacemente;
- anche negli stadi avanzati di retinopatia proliferante, che possono causare grave riduzione visiva a breve termine, è frequente l'assenza di sintomatologia visiva;
- sono disponibili test di screening semplici, rapidi, economici, sensibili e specifici, non invasivi ed accettabili dai pazienti anche in occasioni ripetute;
- sono disponibili forme di trattamento (fotocoagulazione laser) altamente efficaci, soprattutto quando le lesioni sono iniziali e l'acuità visiva non è ancora compromessa;
- lo screening ed il trattamento della retinopatia diabetica costituiscono le procedure con il miglior rapporto costi-efficacia note in Medicina .
Metodologie di screening
Lo screening della retinopatia diabetica, laddove è stato applicato a livello di popolazione [Islanda, Svezia (22,23)], ha permesso di evidenziare una netta riduzione dell'incidenza di nuovi casi di cecità secondaria al diabete. Lo screening della retinopatia diabetica può essere eseguito mediante una o più delle seguenti metodiche:- oftalmoscopia (diretta e/o indiretta);
- biomicroscopia con lenti sia a contatto che non;
- fotografie a colori o in bianco e nero del fondo oculare.
Prima dell'instillazione del collirio ad effetto midriatico si consiglia: a) di indagare se il paziente effettua una terapia antiglaucomatosa da cui si può evincere la presenza di un glaucoma ad angolo stretto, b) di valutare la profondità della camera anteriore dell'occhio allo scopo di evitare, nei soggetti predisposti, l'insorgenza di un attacco di glaucoma acuto.
Vantaggi e svantaggi delle metodiche elencate sono così riassumibili:
- l'oftalmoscopia è poco costosa ed eseguibile con uno strumento facilmente trasportabile, ma richiede l'impiego di personale qualificato e non consente l'archiviazione di dati oggettivi;
- la biomicroscopia permette un'analisi più accurata del polo posteriore rispetto all'oftalmoscopia, ma la valutazione rimane comunque soggettiva e non archiviabile; ha costi elevati e difficoltà per il trasferimento dell'apparecchiatura;
- la fotografia permette di ottenere immagini in genere di qualità e garantisce una documentazione obiettiva archiviabile. Con le nuove apparecchiature digitali, in molti casi è possibile eseguire la fotografia senza dilatazione pupillare farmacologica.
I costi di investimento sono relativamente alti ma è possibile delegare personale tecnico o infermieristico alla sua esecuzione routinaria, riservando l'interpretazione delle immagini agli specialisti.
Scopo dello screening
Lo screening ha l'obiettivo di riconoscere tempestivamente:- le lesioni che identificano la retinopatia ad alto rischio di perdita della vista (retinopatia proliferante ed edema maculare clinicamente significativo);
- le lesioni caratteristiche della retinopatia non proliferante grave. (Nel 40% di questi casi, entro 12 mesi, compare la retinopatia proliferante).
La caratterizzazione delle forme lievi e moderate di retinopatia non è un obiettivo primario dello screening, ma rappresenta un utile strumento per individuare i pazienti a rischio non immediato, che richiedono un follow-up più attento (Tab. 3).
Periodicità e provvedimenti in corso di screening
Le lesioni da ricercare in corso di screening ed i provvedimenti da prendere nelle varie situazioni sono elencati in Tab. 3.La periodicità con cui deve essere eseguito lo screening della retinopatia diabetica è schematizzata in Tab. 4. Nelle donne diabetiche la gravidanza può accelerare il decorso della retinopatia soprattutto se, prima del concepimento, la retinopatia era nello stadio non proliferante moderato o grave o proliferante. Si consigliano pertanto controlli oculistici alla programmazione (quando possibile) del concepimento, alla conferma dello stesso e almeno trimestralmente durante il periodo gestazionale.
Per la realizzazione di un efficace programma di screening è altresì consigliabile l'esame del fondo oculare in tutti i pazienti diabetici ospedalizzati, in caso di insufficienza renale e di malattie intercorrenti di una certa gravitá.
Dato che l'intervento di cataratta può determinare un'accelerazione nell'evoluzione della retinopatia diabetica, è importante che il fondo oculare del paziente diabetico venga valutato ed eventualmente trattato sia prima dell'intervento che appena possibile dopo lo stesso.
Chi deve eseguire lo screening?
Varie figure professionali possono eseguire lo screening in base alle risorse e l'organizzazione disponibili.In ogni caso è necessario promuovere appositi corsi per l'addestramento e l'accreditamento del personale a ciò preposto.
Tab. 3. Screening della retinopatia diabetica (RD): classificazione delle lesioni e urgenza della consulenza oculistica
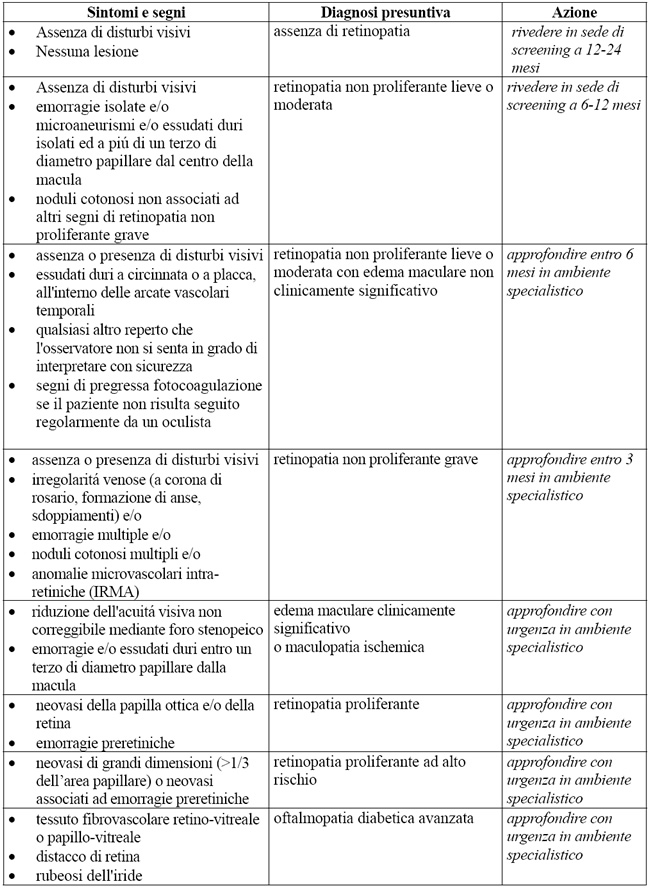
Tab. 4. Periodicità dello screening

Diagnostica della retinopatia diabetica
Quando, attraverso lo screening, siano stati individuati i pazienti che necessitano di approfondimento diagnostico oftalmologico, si rende necessaria l'esecuzione di una visita oculistica completa
Questa deve comprendere:
- determinazione dell'acuità visiva, se necessario con correzione ottica;
- esame della motilità oculare;
- valutazione dei riflessi pupillari;
- misurazione della pressione oculare;
- esame biomicroscopico del segmento anteriore, con particolare attenzione all'eventuale presenza di neovasi a livello dell'iride (da valutare in miosi);
- esame in midriasi del segmento posteriore eseguito con oftalmoscopia diretta e/o indiretta e/o biomicroscopia;
- qualora si voglia documentare obiettivamente le lesioni che caratterizzano la retinopatia, è indicata l'esecuzione di fotografie a colori o in bianco e nero del fondo oculare (retinografia);
Il ricorso alla fluoroangiografia retinica, anche finalizzata al
trattamento laser, è necessario in tutti i casi in cui le lesioni necessitano di un'interpretazione patogenetica, impossibile sulla base del solo esame clinico. In particolare, gli scopi della fluorangiografia retinica sono i seguenti:
- interpretazione patogenetica dell'edema maculare;
- individuazione di neovascolarizzazioni dubbie;
- esatta definizione delle zone retiniche ischemiche;
- studio della macula nei casi di perdita visiva non giustificata clinicamente.
In particolari situazioni cliniche, o per acquisire dati utili a fini prognostici e/o terapeutici, ci si può avvalere dei seguenti ulteriori esami:
- ecografia oculare;
- tomografia oculare a luce coerente ( OCT);
- analisi computerizzata dello spessore retinico (RTA);
- microperimetria (SLO);
- elettroretinografia;
- iridografia.
L'ecografia oculare trova indicazione nei casi in cui la visualizzazione del fondo oculare sia resa difficile da opacità dei mezzi diottrici (cataratta, emorragia endovitreale) o per meglio definire i rapporti anatomici tra corpo vitreo e retina.
OCT e RTA sono esami utili al fine di quantificare e documentare lo spessore retinico a livello maculare e per meglio visualizzare le eventuali trazioni vitreo-retiniche.
La microperimetria e l'elettroretinografia sono indicate per valutare la funzionalità retinica in rapporto alla presenza delle lesioni.
L'iridografia può essere utile per una precoce diagnosi di neovascolarizzazione dell'iride e per avere anche informazioni indirette sulla microangiopatia retinica nei casi in cui questa non sia accessibile ad un esame diretto.
Un rapido miglioramento del controllo metabolico può essere seguito, nel breve termine, da un aggravamento della retinopatia diabetica che tende però a stabilizzarsi nel tempo.
Questa eventualità deve essere tenuta presente soprattutto nell'approccio terapeutico dei pazienti diabetici con retinopatia non proliferante grave, che può evolvere rapidamente nella forma proliferante.
In base a tale studio, ridurre i valori pressori da 154/87 a 144/82, mantenendoli su livelli più bassi di quelli ritenuti accettabili fino a pochi anni addietro, ha ridotto la frequenza e la gravità delle lesioni retiniche.
OCT e RTA sono esami utili al fine di quantificare e documentare lo spessore retinico a livello maculare e per meglio visualizzare le eventuali trazioni vitreo-retiniche.
La microperimetria e l'elettroretinografia sono indicate per valutare la funzionalità retinica in rapporto alla presenza delle lesioni.
L'iridografia può essere utile per una precoce diagnosi di neovascolarizzazione dell'iride e per avere anche informazioni indirette sulla microangiopatia retinica nei casi in cui questa non sia accessibile ad un esame diretto.
Controllo glicemico
Allo scopo di ritardare la comparsa e rallentare la progressione della retinopatia è necessario raggiungere e mantenere nel tempo il miglior controllo possibile della glicemia, modificando lo stile di vita con interventi di educazione sanitaria strutturata, intensificando il trattamento farmacologico e il supporto polispecialistico, come dimostrato dal Diabetes Control and Complications Trial nei diabetici di tipo 1 e dal United Kingdom Prospective Diabetes Study nei diabetici di tipo 2.Un rapido miglioramento del controllo metabolico può essere seguito, nel breve termine, da un aggravamento della retinopatia diabetica che tende però a stabilizzarsi nel tempo.
Questa eventualità deve essere tenuta presente soprattutto nell'approccio terapeutico dei pazienti diabetici con retinopatia non proliferante grave, che può evolvere rapidamente nella forma proliferante.
Pressione arteriosa sistemica
La sensazione clinica che l'ipertensione arteriosa possa peggiorare l'evoluzione della retinopatia ha trovato conferma definitiva in un recente studio clinico.In base a tale studio, ridurre i valori pressori da 154/87 a 144/82, mantenendoli su livelli più bassi di quelli ritenuti accettabili fino a pochi anni addietro, ha ridotto la frequenza e la gravità delle lesioni retiniche.
Gli interventi medici devono pertanto essere finalizzati al raggiungimento dei seguenti obiettivi principali:
L'utilità della cessazione del fumo di sigaretta e del controllo dei lipidi circolanti, benchè utile per la prevenzione di altre patologie vascolari, non è dimostrata nel caso della retinopatia diabetica.
- mantenimento di valori glicemici il più possibile vicini a quelli normali (obiettivo terapeutico < 110 mg/dl a digiuno e < 160 mg/dl 2 ore dopo i pasti, emoglobina glicosilata < 7%)
- trattamento intensivo dell'ipertensione arteriosa (obiettivo terapeutico < 130/85 mmHg), in accordo con le linee-guida della WHO/IHS per il trattamento dell'ipertensione, considerando che un controllo pressorio ancor più stretto si è dimostrato efficace nel ridurre altri tipi di evento, soprattutto cardiovascolari.
Terapia fotocoagulativa della retinopatia diabetica
Nel corso degli ultimi 30 anni sono state ben codificate le indicazioni e le modalità di applicazione della fotocoagulazione laser per il trattamento della retinopatia diabetica ad alto rischio.La fotocoagulazione panretinica è in grado di prevenire la cecità legale in più del 90% dei casi di retinopatia proliferante a 5 anni dalla sua applicazione e di stabilizzare la malattia, come dimostrato in studi clinici con follow-up sino a 14 anni.
In caso di edema maculare (più comune fra i pazienti anziani), la terapia laser permette di preservare una funzione visiva utile nel 50-60% dei casi.
Maculopatia
Il trattamento dell'edema maculare ha lo scopo di ridurre l'accumulo di liquido intraretinico e/o far regredire gli essudati duri presenti.Tecnica di esecuzione Esistono due schemi di trattamento: "focale" e "a griglia".
Il trattamento focale prevede di fotocoagulare, mediante impatti di 150-250 µm, le anomalie vascolari responsabili della diffusione del liquido intraretinico.
L'energia impiegata deve essere sufficiente a produrre un lieve sbiancamento tissutale.
Questo schema trova indicazione nei casi in cui l'edema sia circoscritto.
Il trattamento a griglia prevede di fotocoagulare, mediante impatti di 150-250 µm, tutta la zona edematosa.
L'energia deve essere sufficiente a produrre una lieve decolorazione tissutale, e gli impatti devono essere tra loro separati da una distanza pari al diametro di un impatto.
Per un corretto ed efficace trattamento laser mirato è importante avere la disponibilità di angiogrammi ottenuti nelle fasi precoci e tardive dell'esame fluoroangiografico Il controllo deve essere eseguito entro 3 mesi dal trattamento; in caso di persistenza dell'edema deve essere effettuato un ulteriore trattamento fotocoagulativo.
Il più importante effetto collaterale del trattamento laser dell'edema maculare è la comparsa di scotomi.
Una possibile complicanza è la fibrosi retinica e sottoretinica, che può determinarsi nei casi di edema grave che porta ad effettuare impatti laser con energia troppo elevata.
Retinopatia proliferante
Il trattamento laser è efficace nel migliorare la prognosi visiva nei pazienti affetti da retinopatia proliferante e prevede la fotocoagulazione delle zone di retina ischemica, il cui trattamento determina la regressione delle neovascolarizzazioni.Tecnica di esecuzione
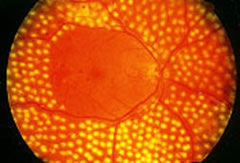
Il trattamento panfotocoagulativo deve consistere in impatti contigui (separati da una distanza pari alla metà del diametro di un impatto), di diametro compreso tra 200 µm (in prossimità del polo posteriore) e 1000 µm (nelle zone più periferiche), di energia sufficiente a produrre uno sbiancamento del tessuto retinico.Quando, per fotocoagulare tutte le zone ischemiche, il trattamento si estende dalla periferia fino alle arcate vascolari temporali esso viene definito pan-retinico.
Sono solitamente necessari 1500-2500 impatti per completare la panfotocoagulazione.
Quando le aree ischemiche non coinvolgono tutti i quadranti retinici, il trattamento può essere meno esteso e risparmiare le zone con buona perfusione ematica.
L'esecuzione del trattamento è resa più accurata dall'individuazione delle zone retiniche ischemiche ottenuta mediante fluorangiografia.
Il trattamento laser viene abitualmente eseguito ambulatoriamente, previa anestesia topica corneale, impiegando, a seconda delle indicazioni e delle preferenze dell'operatore, una delle varie lenti a contatto oggi disponibili (3-specchi, Quadraspheric, Wide-field, Super-Quad, etc.).
In alcuni rari casi il paziente riferisce una sintomatologia dolorosa molto intensa che può rendere necessaria l'esecuzione di un'anestesia peribulbare. La panfotocoagulazione retinica deve essere eseguita con urgenza in tutti i casi di retinopatia proliferante ad alto rischio (neovasi floridi con estensione >1/3 dell'area papillare) e/o emorragie preretiniche.
Nei pazienti che presentano una retinopatia proliferante non ad alto rischio (neovasi della papilla ottica e/o delle altre aree retiniche 1/3 dell'area papillare) oppure una retinopatia non proliferante grave è indicata la panfotocoagulazione se il monitoraggio è reso problematico dalla scarsa collaborazione del paziente o da difficoltà logistiche.
Il più importante effetto collaterale del trattamento panfotocoagulativo è la comparsa o il peggioramento dell'edema maculare.
Allo scopo di ridurre l'incidenza di questa complicanza, è utile suddividere il trattamento in 4-5 sedute distanziandole tra loro di qualche giorno.
Le eventuali lesioni maculari associate ad una retinopatia proliferante non ad alto rischio devono essere laser-trattate almeno due settimane prima dell'inizio della fotocoagulazione retinica periferica (panfotocoagulazione).
In presenza invece di una retinopatia proliferante ad alto rischio, il trattamento maculare deve essere eseguito in concomitanza con l'inizio della panfotocoagulazione.
Altri effetti collaterali del trattamento laser della retinopatia proliferante sono la midriasi, la fotofobia, l'ipoestesia corneale, e la riduzione di ampiezza del campo visivo.
Quest'ultima è un'inevitabile conseguenza del trattamento che comporta la distruzione delle aree retiniche ischemiche.
Il paziente con retinopatia proliferante sottoposto a trattamento laser deve essere controllato dopo un periodo massimo di 3 mesi e, se necessario, sottoposto ad un nuovo ciclo di fotocoagulazioni fino ad ottenere la regressione delle neovascolarizzazioni.
Sebbene nei primi e più importanti trials clinici la fotocoagulazione sia stata condotta con lampada allo xenon e laser ad argon, tutti gli studi condotti successivamente suggeriscono che le varie strumentazioni laser oggi disponibili (argon, krypton, double-frequency Nd:YAG, diodi) hanno la stessa efficacia terapeutica.
Esistono particolari situazioni cliniche di opacità dei mezzi diottrici (cataratta, emorragia endovitreale) in cui il ricorso a strumentazioni laser con lunghezza d'onda lunga (krypton, diodi) può essere indispensabile per raggiungere la retina con quantità di energia sufficienti ad effettuare un corretto trattamento.
Chirurgia vitreo-retinica
Per i pazienti con retinopatia diabetica avanzata (retinopatia proliferante con emorragie vitreali recidivanti e/o distacco retinico trazionale) l'intervento chirurgico di vitrectomia via pars plana è efficace nel ripristinare una visione di 5/10 a due anni dall'intervento stesso, purché questo venga eseguito quando persista una relativa integrità anatomofunzionale dell'area maculare.La vitrectomia associata a fotocoagulazione endoculare, deve essere eseguita nelle seguenti condizioni:
- grave emorragia endoculare che non si riassorbe spontaneamente entro 3 mesi;
- persistenza di retinopatia proliferante evolutiva nonostante il trattamento panfotocogulativo già eseguito per via transpupillare;
- distacco maculare trazionale di recente insorgenza;
- distacco retinico misto o combinato trazionale e regmatogeno;
- rubeosi dell'iride, se associata ad emorragia vitreale che non consenta l'esecuzione di una fotocoagulazione panretinica transpupillare.
Supporto agli ipovedenti
Le misure di supporto per i pazienti con deficit visivo sono al momento insoddisfacenti.Gli operatori sanitari, nel territorio e negli ospedali, spesso non sono informati e non hanno accesso alle possibilità di supporto economico (ad es. facilitazioni per i trasporti pubblici), ai servizi (disponibili sia a cura del SSN che delle associazioni di volontariato) o ai dispositivi (ausili per ipovedenti) cui i pazienti avrebbero diritto.
torna al menù
Raccomandazioni per lo screening della retinopatia in Italia
La retinopatia rappresenta una sfida alle capacità diagnostiche, ma soprattutto organizzative del sistema sanitario italiano.Le dimensioni socio-sanitarie del problema sono rilevanti.
La prevalenza del diabete nei paesi industrializzati è stimata attualmente al 3% con una netta tendenza all'incremento tanto che ne è previsto un raddoppio nel corso dei prossimi 15-20 anni.
Se, come risulta dai dati epidemiologici, il 3-5% di tali pazienti è affetto da retinopatia ad alto rischio, 60.000-100.000 cittadini italiani sarebbero a rischio di cecità se non individuati e curati in tempo.
Un programma nazionale di screening dovrebbe identificare tutti i cittadini a rischio e organizzare una procedura che consenta di convocare i pazienti e richiamarli in relazione ai dati clinici riscontrati. Nel nostro Paese non esiste un sistema di registrazione delle patologie croniche e pertanto non sono disponibili dati affidabili sulla prevalenza della malattia diabetica. L'unica fonte disponibile è quella riguardante la concessione dell'esenzione per patologia che, seppure non esaustiva, rappresenta un indicatore della prevalenza delle patologie croniche nella popolazione.
La disponibilità di un sistema informatizzato fornirebbe un necessario supporto ai programmi di screening e conseguente prevenzione delle complicanze del diabete.
In base alle risorse disponibili, alla realtà locale ed all'organizzazione sanitaria, lo screening della retinopatia diabetica può essere realizzato con approcci differenti, a seconda delle diverse realtà geografiche, economiche e demografiche del nostro Paese.
La responsabilità di coordinare lo screening è dei medici e delle strutture che seguono regolarmente i pazienti diabetici.
Valgono al riguardo alcune raccomandazioni di ordine generale:
- il medico di famiglia deve definire le modalità di screening per quei pazienti che non vengono seguiti regolarmente in una struttura di diabetologia. Lo screening può essere organizzato all'interno dell'ambulatorio di medicina di base, meglio se in forma associazionistica, qualora sia disponibile la professionalità specifica, oppure il paziente può essere inviato a consulenza presso una struttura specialistica;
- le strutture complesse di diabetologia devono dotarsi delle procedure e/o strutture necessarie per eseguire o far eseguire lo screening dei pazienti ad essi afferenti e di quelli inviati dai medici di famiglia o dalle Unità Operative ospedaliere di ricovero e cura;
- in entrambi i casi è indispensabile agire in collaborazione con la struttura oculistica più vicina attrezzata per la diagnosi e la terapia della retinopatia diabetica a rischio, stabilendo adeguati canali di rapida presa in carico dei pazienti identificati durante lo screening;
- è incoraggiata la creazione di strutture integrate per lo screening e la terapia della retinopatia diabetica (Centri Retinopatia Diabetica).
Per quanto riguarda la consapevolezza e la proprietà dei dati clinici, ad ogni paziente deve essere rilasciata una scheda che riporti data e risultato dell'ultimo esame di screening insieme alla data dell'appuntamento successivo.
E' necessario sottolineare l'importanza di questo tipo di documentazione per i pazienti.
Risorse per lo screening ed il trattamento della retinopatia diabetica in Italia.
La rete dei medici di famiglia
Il sistema sanitario italiano individua quale figura di primo riferimento il medico di famiglia che, adeguatamente attrezzato e motivato, tiene aggiornata una scheda contenente un "minimum data set" di dati clinici utili ad una corretta gestione delle patologie croniche.Data una prevalenza della malattia diabetica diagnosticata di circa il 3%, si può stimare in Italia una popolazione di circa 1.800.000 diabetici.
Essendo i medici di famiglia 55.000, ciò significa un carico medio di circa 33 soggetti diabetici per medico, di cui 1-2 affetti da retinopatia grave.
Le stime attuali indicano in circa il 50% del totale i pazienti diabetici seguiti esclusivamente dai medici di famiglia.
Il medico di famiglia, capillarmente ed omogeneamente presente sul territorio nazionale (uno ogni 1000 abitanti), è attore della gestione e del coordinamento dello screening oftalmologico della popolazione diabetica a lui afferente.
Ciò può avvenire direttamente, oppure individuando nel distretto un medico di famiglia che funga da riferimento per i colleghi dello stesso ambito territoriale, oppure ancora inviando i pazienti a consulenza presso strutture attrezzate per lo screening nelle Unità Operative di Malattie Metaboliche e Diabetologia, di Oculistica o in Centri Retinopatia Diabetica dedicati.
Questo modello organizzativo (preceduto da un periodo adeguato di addestramento alla corretta interpretazione del fundus e da uno stretto e costante collegamento con un centro oculistico/diabetologico di riferimento) consentirebbe di rendere capillare la diffusione dello screening e facilitare l'accesso dei pazienti a tale procedura.
E' anche ipotizzabile, in particolari situazioni ed aree geografiche, l'utilizzo di tecnologie di telemedicina che consentirebbero la trasmissione e la refertazione a distanza da parte di centri di riferimento qualificati.
In tale contesto, la cartella clinica elettronica (adeguatamente strutturata con dati clinici condivisi e codificati) rappresenterebbe un utile metodo di comunicazione tra i sanitari coinvolti nella cura del paziente.
Il rapporto diretto e costante esistente fra medico di famiglia e cittadino può favorire la precoce individuazione delle complicanze secondarie al diabete e portare, nel tempo, ad una netta riduzione degli esiti più gravi come la cecità.
La rete delle Unità Operative di Malattie Metaboliche e Diabetologia.
L'attuazione di programmi di screening per la prevenzione delle complicanze della malattia diabetica è funzione attribuita ai servizi specialistici di Diabetologia (Legge 16 marzo 87, n. 115, art.5, comma 3) che, secondo le stime attuali, seguono circa il 50% dei pazienti diabetici italiani.Leggi regionali attuative (ad esempio la Legge Regionale del Piemonte 7/04/00 n°34) assicurano la definizione diagnostica ed il trattamento di dette complicanze, creando collegamenti con le altre Unità Operative Specialistiche.
L'efficacia degli interventi sarà ottimale laddove si riesca a realizzare la gestione integrata della patologia diabetica tra servizi specialistici e medico di famiglia. Lo screening della retinopatia diabetica, gestito dal Servizio di Diabetologia direttamente o in consulenza al medico di famiglia, necessita dell'individuazione di spazi, tempi, operatori medici, personale infermieristico e tecnico ben definiti.
Lo screening deve essere proposto a tutti i pazienti diabetici seguiti, dopo averli informati sulle sue finalità anche mediante l'utilizzo di materiale appositamente predisposto (vedi Appendice 1). L'ormai diffusa gestione informatizzata dei servizi specialistici, soprattutto in collegamento con la cartella clinica elettronica, faciliterà la gestione interdisciplinare dell'assistenza al cittadino.
In particolare per le fasi di approfondimento diagnostico e della terapia è indispensabile la collaborazione e il collegamento con le UU.OO. di Oculistica.
Tale collaborazione dovrà essere promossa ed incoraggiata dalle Aziende Sanitarie, anche tramite progetti-obiettivo finalizzati a creare percorsi clinici ed amministrativi che superino gli ostacoli che attualmente si frappongono ad una rapida ed efficace gestione della retinopatia diabetica nell'ambito del Servizio Sanitario pubblico.
Infatti, interventi di questo tipo nelle patologie croniche e sociali, oltre che di beneficio per il cittadino interessato, sono garanzia di risparmio per l'intera società e sono giustificati e necessari in quanto le complicanze oculari del diabete mellito (definito malattia sociale dal D.M 20/12/1961) necessitano di interventi suppletivi ed integrativi all'ordinaria assistenza sanitaria.
Le Unità Operative Oculistiche di riferimento
Le Unità Operative Oculistiche di riferimento, opportunamente attrezzate per la diagnostica e la terapia fotocoagulativa e chirurgica della retinopatia diabetica devono programmare percorsi adeguati a garantire l'immediata presa in carico dei pazienti che in fase di screening siano stati segnalati come a rischio di perdita della funzione visiva.Centri Retinopatia Diabetica
Anche quando lo screening venga eseguito regolarmente, tempi di attesa eccessivamente lunghi per le successive fasi di diagnosi e terapia possono determinare molti casi di deficit visivo, altrimenti evitabile.L'intenso carico di lavoro delle Unità Operative Oculistiche è senz'altro uno dei motivi di tali ritardi. Tale problema è correggibile con la creazione di centri specialistici finalizzati, attrezzati per eseguire screening, diagnosi e terapia fotocoagulativa nello stesso ambito.
Centri Retinopatia Diabetica così concepiti sono in grado di:
- eseguire lo screening per conto dei medici di famiglia, delle Unità Operative di Malattie Metaboliche e Diabetologia e delle Unità Operative ospedaliere,
- procedere tempestivamente agli approfondimenti diagnostici ed alla terapia, quando necessario, riducendo drasticamente i tempi di attesa e quindi ottimizzando le possibilità di prevenire la perdita di funzione visiva,
- comunicare i risultati delle procedure eseguite ai sanitari invianti,
- ridurre i costi dello screening sia per il sistema sanitario nazionale che per i pazienti,
- fungere da riferimento, con collegamenti di telemedicina, per altre strutture che eseguono lo screening fotografico,
- in collaborazione con i medici di famiglia e le Unità Operative di Malattie Metaboliche e Diabetologia, svolgere funzione di controllo e verifica di qualità, raccogliendo dati per la successiva valutazione della completezza, dell'impatto e dell'appropriatezza delle procedure di screening eseguite nel territorio di competenza.
Verifica e Controllo di Qualità
Le attività di verifica (sia di processo che di esito) e di controllo di qualità rappresentano una responsabilità comune alle diverse figure professionali coinvolte.La verifica potrà essere completa in ogni suo aspetto solo con la creazione di registri di area per il diabete.
Le informazioni da raccogliere includono:
- La percentuale di pazienti sottoposti a screening rispetto al totale dei pazienti diabetici noti
- Il minimo concordato di informazioni da raccogliere per ogni paziente
- Il numero di soggetti che non hanno aderito al programma di screening
- Le procedure messe in atto per richiamare chi ha partecipato e chi non ha partecipato allo screening.
Come 'gold standard' rispetto al quale le prestazioni individuali vengono confrontate potrà essere utilizzato il sistema di fotografie standard del fundus in un gruppo di pazienti selezionati a random, con valutazione delle fotografie da parte di un centro indipendente; in alternativa si potranno utilizzare i riscontri dell'esame oftalmologico fatto dallo specialista sul gruppo di pazienti identificati in modo randomizzato.
La misura finale di risultato dello screening sarà rappresentata dall'incidenza di cecità e di disabilità visiva grave dovute al diabete
Gli amministratori e i responsabili delle attività di verifica dovranno interpretare queste informazioni con grande attenzione, poiché le casistiche locali potrebbero apparire numericamente ridotte e portare erroneamente all'adozione di standard non adeguati.Sfortunatamente le informazioni di base a disposizione sono incomplete e poco valide e una valutazione di risultato basata sul numero di pazienti trattati con laser (per prevenire la cecità) rappresenta un outcome surrogato imperfetto.
E' perciò urgente che gli amministratori assicurino che, almeno per questa patologia, si provveda ad un'adeguata raccolta dei dati.
La misura dell'acuità visiva in tutti i pazienti sottoposti a screening rappresenta una parte essenziale del processo.
Utilizzo delle Linee Guida nazionali
Questo documento non è stato stilato con l'intenzione di farne uno standard per la pratica clinica.Gli standard per la pratica clinica sono determinati sulla base di tutti i dati clinici disponibili per ogni singolo caso e sono soggetti a cambiamenti con l'evoluzione delle conoscenze e con i progressi della tecnologia.
- Questi parametri per la pratica clinica dovrebbero pertanto essere considerati solo come linee-guida. L'adesione a queste raccomandazioni non potrà assicurare un risultato positivo in ogni caso. Inoltre queste linee guida non vanno interpretate come comprensive di tutti i metodi adeguati di assistenza; altri metodi per raggiungere gli stessi scopi, non contemplati da queste linee-guida, potrebbero essere accettabili o diventarlo in futuro.
- Il giudizio finale riguardo una particolare procedura clinica o un piano terapeutico spetta al medico, alla luce dei dati clinici presentati dal paziente e delle opzioni diagnostiche e terapeutiche disponibili.
- Nella definizione di protocolli locali, scostamenti significativi dalle linee guida nazionali dovrebbero essere documentate in modo esaustivo e le ragioni di tale scostamento spiegate in dettaglio.
- Scostamenti significativi dai protocolli locali dovrebbero essere documentati dettagliatamente sulla cartella clinica del paziente nel momento in cui vengono prese tali decisioni.
Conclusioni
- La retinopatia diabetica rappresenta una causa comune e prevenibile di severa compromissione della vista e di cecità.
- Lo screening della retinopatia diabetica in tutti i soggetti di età superiore a 12 anni rappresenta l'unico mezzo per prevenire la perdita della vista. Le opzioni disponibili per l'attività di screening sono descritte e dovrebbero essere utilizzate in modo appropriato dal Sistema Sanitario Nazionale.
- Il trattamento della retinopatia diabetica deve essere rapidamente disponibile per tutti i pazienti che ne necessitano. Le strutture ed il personale qualificato per la laserterapia devono essere disponibili in tutte le Aziende Sanitarie, mentre centri specializzati nella chirurgia vitreo-retinica devono essere presenti almeno a livello regionale.
- L'assistenza ai soggetti diabetici non vedenti o con compromissione grave del visus non è attualmente soddisfacente, ma esiste un ampio margine di miglioramento con un uso appropriato delle risorse esistenti.
- Un programma completo di screening e di trattamento richiede la creazione di registri per il diabete che coprano tutti i soggetti di una specifica area (ASL, regione). Allo stato attuale questi registri non esistono in nessuna regione italiana e dovrebbero pertanto essere attivati senza ulteriori ritardi. A tal fine sono necessari significativi investimenti nel settore dell'information technology e della informatizzazione. Su base nazionale, considerazioni simili si applicano per la creazione di un registro dei non vedenti.
- L'implementazione delle raccomandazioni contenute in questo documento ha le potenzialità per migliorare in futuro lo stato di salute dei soggetti diabetici in Italia.
torna al menù
Diabetic Retinopathy Screening (DRS) and the Ophthalmology Clinic set up in England
 di:
The Royal College of Paediatrics and Child Health and The Royal College of Ophthalmologists
di:
The Royal College of Paediatrics and Child Health and The Royal College of OphthalmologistsScarica il pdf
torna al menù
Müller Cells as Players in Retinal Edema
Di Andreas Bringmann, MDScarica il pdf
Macular edema is a major cause of vision loss.
The accumulation of water within the macular tissue and in the subretinal space is associated with functional impairment of photoreceptors and retinal neurons.
Water may accumulate within retinal cells (cytotoxic edema characterized by cellular swelling) and in interstitial spaces (extracellular edema resulting in cell compression). Systemic and retinal factors may contribute to the development of macular edema.
Systemic disorders result in inflow of excess water from the blood into the retinal tissue, either by increase in hydrostatic pressure (hypertension) or decrease in blood osmolarity (eg, in cases of hyponatremia and hypoalbuminemia).
(Fig.1) Main retinal factors are ischemia-hypoxia (associated with oxidative stress) and local inflammation.
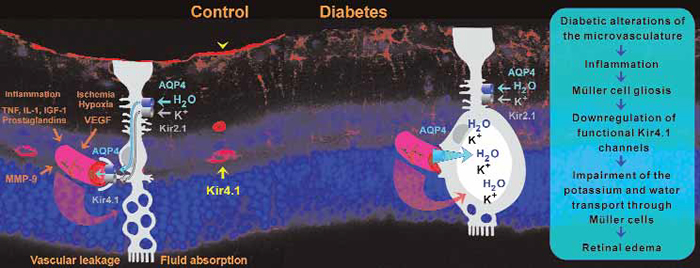
Figure 1. Disruption of Müller cell-mediated fluid clearance and (under certain conditions) Müller cell swelling may contribute
to the development of diabetic retinal edema. In a rat model of diabetic retinopathy, the major potassium channel of Müller
cells (Kir4.1), which is normally expressed around the retinal vessels (yellow arrow) and at the inner limiting membrane (yellow
arrowhead) is downregulated.This disrupts the water transport through the cells, which is facilitated by water channels (AQP4),
and coupled to potassium currents through potassium channels (Kir2.1,Kir4.1).Accumulation of potassium within the cells
increases the intracellular osmotic pressure, resulting in water influx into the cells and cellular swelling.
VASCULAR LEAKAGE VS IMPAIRMENT IN FLUID CLEARANCE
Retinal ischemia-hypoxia and inflammation are associated with release of factors that promote breakdown of the blood-retinal barrier (vascular endothelial growth factor [VEGF], various inflammatory factors, and matrix-metalloproteinases).Blood-derived fluid moves across the leaky pigment epithelium and vessel walls into the tissue (vasogenic edema).
Generally, water accumulation within the retinal tissue results from an imbalance between the rate of fluid inflow into the retinal tissue and the rate of fluid absorption from the retina into the blood.
It has been suggested that anomalies in vessel permeability must be accompanied by ineffective edema-resolving mechanisms to result in chronic edema.
An impairment in the fluid-clearance mechanisms is a major cause of macular edema in patients without angiographic vascular leakage.
Diabetic macular edema develops when the active transport mechanisms of the blood-retinal barrier are dysfunctional.<
FLUID ABSORPTION FROM THE RETINAL TISSUE
Under normal conditions, water accumulates in the retinal tissue due to various reasons, including the uptake of nutrients from the blood, which is associated with water inflow into the tissue, and the production of water in the course of aerobic energy production.(The oxidative breakdown of one molecule of glucose results in the formation of 42 molecules of water.)
The accumulation of metabolic water is strongest in the macular tissue because of the high density of highly metabolically active photoreceptors.
Of all the cells of the body, photoreceptor cells probably have the highest rate of oxidative metabolism.
There is a continuous redistribution of metabolic water from the retinal tissue into the blood carried out by Müller cells, which dehydrate the retinal parenchyma, and pigment epithelial cells, which dehydrate the subretinal space.
The water transport through Müller and pigment epithelial cells is osmotically driven by transcellular currents of osmolytes, especially of potassium ions.
To facilitate the transport process, the cells express potassium- and water-selective channels (aquaporins) in their membranes.
DYSFUNCTION OF MÜLLER CELLS
Chronic macular edema is characterized by an impairment in the fluid clearance from the retinal tissue.Because Müller cells dehydrate the retinal tissue, we determined the properties of the cells in animal models of various retinopathies known to be associated with development of edema (eg, ischemia,4 ocular inflammation, diabetes,5 and blue-light evoked retinal degeneration).
6 We found that in all these cases the potassium currents across the Müller cell membranes are strongly decreased due to the downregulation of potassium channels, which are normally localized to Müller cell membranes that surround the blood vessels.
An impairment of the potassium transport through Müller cells should also disrupt the regular osmotically driven water transport through the cells and, thus, the fluid clearance from the retinal tissue. We investigated the water transport across Müller cell membranes in osmotic cell swelling experiments.
We found that Müller cells in tissue slices of pathologically altered retinas displayed cellular swelling during superfusion with a hypoosmolar solution, whereas Müller cells of control retinas do not swell under such osmotic stress conditions.
The swelling of Müller cells, which is not seen under normal conditions, reflects an alteration in the water transport through the cells. The results suggest that a disturbance in the potassium and water transport through Müller cells contributes to the development of retinal edema.
Are these results applicable to the human situation? We found in preliminary experiments using retinal tissues from patients with choroidal melanoma that Müller cells with reduced potassium currents display osmotic swelling, while cells with normal potassium currents do not swell under osmotic stress conditions.
An age-related decrease in potassium channel expression of human Müller cells7 may contribute to the higher incidence of macular edema in the elderly.
In cases of macular edema caused by systemic disorders, a considerable amount of water that flows into the retinal parenchyma will directly move into the Müller cells, because the perivascular processes of Müller cells fill most of the space around the blood vessels.
Under these conditions, the water flow from the blood into the tissue may overtax the capability of Müller cells to clear the retina from excess water.
MÜLLER CELL SWELLING
Impaired fluid clearance may result in cytotoxic edema characterized by cellular swelling.In the ischemic retina, both a rapid neuronal cell swelling and a slow Müller cell swelling were suggested to contribute to the thickening of the retinal tissue.
Swelling of retinal neurons follows from malfunction of mitochondria caused by reactive oxygen radicals, which results in dysfunctional ion transport across the neuronal membranes and a sustained activation of ionotropic receptors due to pathological increase in extracellular glutamate.
Müller cell swelling results from the downregulation of potassium channels through which the cells normally extrude potassium into the blood vessels.
Because the cells are capable of taking up excess potassium from the retinal interstitium but are unable to release the ions, potassium accumulates within the cells; the increase in the intracellular osmotic pressure will cause an osmotic influx of water from the blood into the cells, resulting in cellular swelling.
We found that various other factors that are known to contribute to edema formation, such as oxidative stress and inflammatory factors like prostaglandins, contribute to the induction of Müller cell swelling.
It remains to be determined, however, whether Müller cell swelling really contributes to the development of edema.
In animal models of retinal hypoxia, vascular leakage is accompanied by cellular edema of Müller cells.
Some previous electron microscopic studies suggest that in addition to ischemic changes in the retinal microvasculature, swelling of Müller cells contributes to the development of cystoid macular edema, with the cysts being formed by swollen and necrotic Müller cells, while other studies do not describe swollen Müller cells.
In the brain, swelling of astrocytes (especially of their perivascular processes) usually occurs concomitantly in vasogenic edema.
Most likely, the relative contribution of vasogenic edema and dysfunction of Müller cells to the formation of retinal edema varies in dependence on the specific conditions in individual patients.
STIMULATION OF FLUID CLEARANCE BY TRIAMCINOLONE ACETONIDE?
Resolution of retinal edema can be obtained by reducing the fluid inflow from the blood and by stimulation of the fluid clearance from the retinal tissue.The antiinflammatory steroid triamcinolone acetonide reduces vascular leakage via several mechanisms, including inhibition of the production and release of VEGF, inflammatory factors, and matrix metalloproteinases.
We found that triamcinolone acetonide inhibits the osmotic swelling of Müller cells.
Triamcinolone acetonide stimulates the release of endogenous adenosine from the retinal tissue; adenosine activates adenosine A1 receptors, which results in the opening of potassium channels in the Müller cell membranes.
The outflow of potassium ions from the cells balances the osmotic gradient across the membranes and thus prevents cellular swelling. In swollen cells, the outflow of potassium ions is associated with an efflux of water, resulting in shrinkage of the cells.
We suggest that triamcinolone acetonide stimulates the fluid absorption from the retinal tissue because opening of ion channels in Müller cell membranes improves the transport of osmolytes and, thus, of water through the cells.
The observation that triamcinolone acetonide resolves macular edema also in patients who do not display angiographic vascular leakage suggests that it stimulates the fluid absorption from the retinal tissue.
Selective pharmacologic activation of A1 receptors may represent a method for rapid resolution of retinal edema.
A similar resolution of subretinal edema can be achieved by pharmacologic activation of purinergic receptors on retinal pigment epithelial cells.
Release of endogenous adenosine and subsequent activation of A1 receptors is an important component of the retinal response to ischemic-hypoxic stress.
Adenosine protects retinal neurons from hyperexcitation and glutamate toxicity.
This effect will also prevent the glutamate-evoked swelling of retinal neurons as another component of edema formation.
torna al menù
Diabetic Retinopathy
from The New England Journal of Medicine Posted by Sara Fazio
Link: blogs.nejm.org
Link: blogs.nejm.org
 The incidence of diabetes is increasing, but that of diabetic retinopathy is falling, probably owing to better
management of glucose levels, lipid abnormalities, and hypertension. Clinical trials of VEGF and PPAR-a inhibitors
are improving vision and providing insights into pathogenesis. The latest article in our Mechanisms of Disease review
series, Diabetic Retinopathy, comes from Drs. David Antonetti and Thomas Gardner of the University of Michigan
Medical School, and Dr. Ronald Klein of the University of Wisconsin School of Medicine and Public Health.
The incidence of diabetes is increasing, but that of diabetic retinopathy is falling, probably owing to better
management of glucose levels, lipid abnormalities, and hypertension. Clinical trials of VEGF and PPAR-a inhibitors
are improving vision and providing insights into pathogenesis. The latest article in our Mechanisms of Disease review
series, Diabetic Retinopathy, comes from Drs. David Antonetti and Thomas Gardner of the University of Michigan
Medical School, and Dr. Ronald Klein of the University of Wisconsin School of Medicine and Public Health.Until recently, the treatment for diabetic retinopathy relied almost exclusively on managing the metabolic dysregulation of diabetes mellitus until the severity of the vascular lesions warranted laser surgery.
Intensive metabolic control remains a highly effective means of controlling retinopathy and other diabetes-related complications in many patients.
Clinical Pearls
What is the clinical presentation of diabetic retinopathy?The features of diabetic retinopathy, as detected by ophthalmoscopy, were described in the 19th century. The involved changes begin with microaneurysms and progress into exudative changes (leakage of lipoproteins [hard exudates] and blood [blot hemorrhages]) that lead to macular edema, ischemic changes (infarcts of the nerve-fiber layer [cotton-wool spots]), collateralization (intraretinal microvascular abnormalities) and dilatation of venules (venous beading), and proliferative changes (abnormal vessels on the optic disk and retina, proliferation of fibroblasts, and vitreous hemorrhage). Persons with mild-to-moderate nonproliferative retinopathy have impaired contrast sensitivity and visual fields that cause difficulty with driving, reading, and managing diabetes, and other activities of daily living.
Visual acuity, as determined with the use of Snellen charts, declines when the central macula is affected by edema, ischemia, epiretinal membranes, or retinal detachment.
does strict metabolic control impact the incidence and progression of diabetic retinopathy?
Epidemiologic studies have shown the effects of hyperglycemia, hypertension, and dyslipidemia and, to a lesser extent, a high body-mass index, a low level of physical activity, and insulin resistance on the incidence and progression of diabetic retinopathy and clinically significant macular edema. The Diabetes Control and Complications Trial (DCCT) showed that intensive metabolic control reduces the incidence and progression of diabetic retinopathy. Although the glycated-hemoglobin level is the standard clinical index for predicting the development and progression of diabetic retinopathy, this index accounted for only 11% of the risk of retinopathy in the DCCT. Similarly, the values for glycated hemoglobin, blood pressure, and total serum cholesterol accounted for only 9 to 10% of the risk of retinopathy in the Wisconsin Epidemiologic Study of Diabetic Retinopathy. Proliferative diabetic retinopathy and other complications develop after 30 years in up to 20% of persons with diabetes who have been treated with intensive metabolic control, and ideal metabolic control is difficult to achieve because of the increased risk of hypoglycemia and the nonphysiologic route of insulin administration.Morning Report Questions
Q: What medical interventions have been shown to be helpful in preventing diabetic retinopathy?A: Large, randomized trials have revealed that metabolic control, the renin-angiotensin system, peroxisome proliferator-activated receptor alpha (PPAR-alpha), and VEGF contribute to human pathophysiology. Notably, renin- ngiotensin system inhibitors reduce the incidence and risk of progression of diabetic retinopathy in persons with type 1 diabetes and are now standard therapy. The PPAR-alpha agonist, fenofibrate, reduces the risk of progression by up to 40% among patients with nonproliferative retinopathy, as shown in the Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) and the Action to Control Cardiovascular Risk in Diabetes (ACCORD) studies.
The ACCORD study did not show an effect of intensive blood-pressure control on retinopathy progression but did show the benefit of intensive glycemic control in preventing the progression of retinopathy.
Q: What eye-specific treatments are beneficial in patients with diabetic retinopathy?
A: Eye-specific treatments are beneficial in patients whose vision is threatened by macular edema. Use of the VEGF- eutralizing antibodies bevacizumab and ranibizumab improves visual acuity by an average of one to two lines on a Snellen chart, with an improvement of three or more lines in 25 to 30% of patients, and loss of visual acuity decreased by one third.
These improvements, which are seen over a period of 2 years after approximately 10 intraocular injections, are significantly better than the results of laser treatment alone. The VEGF aptamer, pegaptanib, improves visual acuity by approximately one line. Sustained intravitreal delivery of fluocinolone yields a similar likelihood of gaining three or more lines of acuity but with a 60% increase in the risk of glaucoma and a 33% increase in the need for cataract surgery.
The same implant technology delivering a lower dose of fluocinolone did not increase the risk of cataract or glaucoma. Glucocorticoids such as fluocinolone reduce retinal inflammation and may restore the integrity of the blood-retinal barrier by increasing tight-junction protein expression.
Eye Diseases: Diabetic Retinopathy
from neohioeyes.comDiabetic Retinopathy
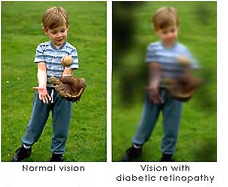 Diabetic retinopathy is a potentially blinding complication of diabetes that damages the retina. It affects half of
those diagnosed with diabetes.
Diabetic retinopathy is a potentially blinding complication of diabetes that damages the retina. It affects half of
those diagnosed with diabetes.
Diagnosis of Retinopathy
In the early stages there are no symptoms of the disease. It can progress over time and lead to vision loss. With routine, dilated, yearly, eye examinations and early treatment, 90% of those with advanced retinal disease can be saved from blindness.Treatment
The retina is a light-sensitive tissue in the back of the eye that transmits light into nerve signals that the brain interprets. Without the retina, there is no communication with the brain, making vision impossible. Diabetes affects the tiny blood vessels that nourish the retina. When the vessels are damaged, they can leak serum, blood, and lipids into the central part of the retina called the macula.This causes vision to become blurred but can be treated with laser therapy. A high-energy beam of light is focused onto the damaged blood vessels which seals off the leaking. It may take more than one treatment to seal off the damaged blood vessels.
Another form of diabetic retinopathy is called Proliferative Diabetic Retinopathy. This is an advanced form of retinopathy that occurs when the disease progresses.
Diagnosis of Proliferate Retinopathy
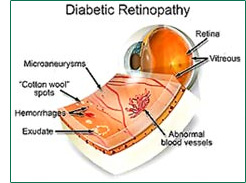 When the damaged blood vessels leak, the retina does not get oxygen and other vital nutrients it needs to function.
This stimulates new blood vessel growth. The problem with these new vessels is that they are fragile and prone to
hemorrhaging which can destroy the retina.
When the damaged blood vessels leak, the retina does not get oxygen and other vital nutrients it needs to function.
This stimulates new blood vessel growth. The problem with these new vessels is that they are fragile and prone to
hemorrhaging which can destroy the retina.
Treatment
Laser is used to destroy the abnormal blood vessels that form in the retina. Instead of focusing the light on a single spot, hundreds of small laser burns are applied to the retina away from the macula.This treatment shrinks the abnormal vessels but some of the side vision and night vision are permanently affected. However, without the treatment, total blindness can occur. If a large hemorrhage occurs in the jelly-like substance called the vitreous that is located in the front of the retina, a surgical procedure called a vitrectomy may be needed. This involves removing the cloudy and blood-filled vitreous and replacing it with a clear salt solution.
Prevention
Although laser and vitrectomy are successful, they do not cure diabetic retinopathy. Prevention of retinopathy is the best method to preserve vision. Checking blood sugar, controlling diet, and increasing exercise is the best way to minimize your risk of developing diabetic retinopathy.If you are diabetic, a dilated, yearly, eye examination is mandatory to diagnose retinopathy before it enters into an advanced stage.


