Anatomia e fisiologia dell'occhio umano
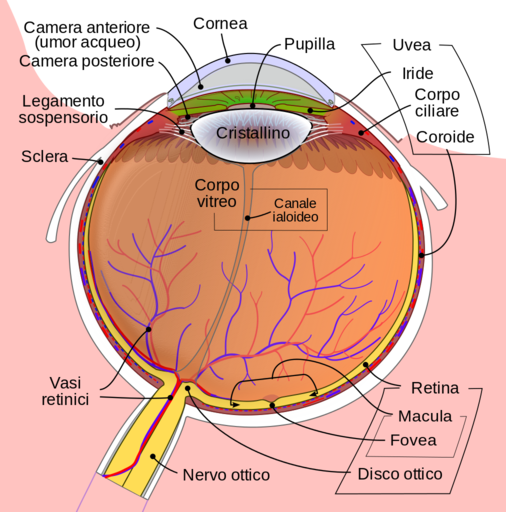
Si chiude sul davanti con una membrana trasparente, la cornea, che si incastra come un vetro d'orologio alla sclera e che ne è la sua prosecuzione in avanti.
Nel suo interno sono contenuti due liquidi che oltre a provvedere al nutrimento delle varie strutture, danno consistenza e volume al globo oculare.
Il primo liquido che troviamo è l'umore acqueo che occupa lo spazio della camera anteriore, cioè lo spazio compreso tra superficie posteriore della cornea e superficie anteriore del cristallino.
Il secondo liquido, di consistenza gelatinosa, è l'umore vitreo che occupa la cavità vitrea, spazio compreso tra la superficie posteriore del cristallino e la retina.
Esso è contenuto dalla membrana ialoidea, molto sottile, adesa alla retina.
- Anatomia e fisilogia dell'apparato visivo
- Cenni di anatomia e fisiologia oculare
- Autofluorescenza
- Cristallino o Lente
- Fotografia del fondo oculare (lingua spagnola)
- Il Segmento Anteriore e Posteriore
- Iride e Pupilla
- La Cornea
- La Retina
- Anatomy and pathology of the Vitreo-Retinal interface
- Le tipologie di chirurgia
- Nuova Nomenclatura OCT
- Nervo Ottico
- Lamina Cribrosa
- Test di Amsler Multicolor (di Amedeo Lucente)
- Test di Schirmer
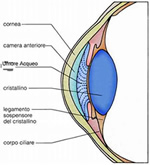
Il Segmento Anteriore e Posteriore
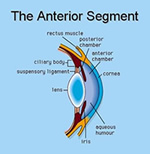 Il cosiddetto segmento anteriore del bulbo oculare è la parte visibile dell'occhio e comprende la cornea, la
camera anteriore, l'iride, il forame centrale pupillare, il cristallino con le strutture che lo sostengono, cioè l'apparato
zonulare, il corpo ciliare che prosegue anteriormente con l'iride e che si continua con la coroide posteriormente.
Il cosiddetto segmento anteriore del bulbo oculare è la parte visibile dell'occhio e comprende la cornea, la
camera anteriore, l'iride, il forame centrale pupillare, il cristallino con le strutture che lo sostengono, cioè l'apparato
zonulare, il corpo ciliare che prosegue anteriormente con l'iride e che si continua con la coroide posteriormente.In oftalmologia la suddivisione del bulbo nei due segmenti anteriore e posteriore è molto importante sia per la chirurgia che per la diagnostica.
Anche i chirurghi sono di solito dedicati o al segmento anteriore o a quello posteriore e raramente sono ugualmente eccellenti in entrambi i settori.
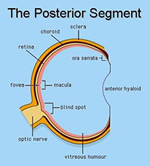 Il cosiddetto segmento posteriore del bulbo si estende quell'area anatomica che va dalla superficie
posteriore del cristallino alla retina con il corpo vitreo che riempie la cavità omonima.
Il cosiddetto segmento posteriore del bulbo si estende quell'area anatomica che va dalla superficie
posteriore del cristallino alla retina con il corpo vitreo che riempie la cavità omonima.La diagnostica di tale segmento e ancor più la chirurgia si avvalgono di strumenti e di tecniche le più sofisticate ed elettive, idonee per osservare ed intervenire su strutture molto delicate ed estremamente vulnerabili. La chirurgia della retina e del vitreo sono sempre molto evolute ed in continuo cambiamento.
 L'immagine, una volta passate le cellule retiniche, viene inviata attraverso il nervo ottico alle aree celebrali primarie e
secondarie deputate alla visione nitida, aree corticali occipitali (17,18,19).
L'immagine, una volta passate le cellule retiniche, viene inviata attraverso il nervo ottico alle aree celebrali primarie e
secondarie deputate alla visione nitida, aree corticali occipitali (17,18,19).Il nervo ottico è formato da circa 1 milione di fibre che sono il prolungamento delle cellule ganglionari della retina. L'immagine oftalmoscopica del nervo ottico è nota come papilla ottica.
L'esame della papilla è fondamentale per molteplici patologie sopratutto per il glaucoma e per le malattie neurologiche.
La Cornea
 La cornea è la prima lente naturale che la luce incontra, è determinante che sia trasparente e di forma più
o meno sferica. La diversa curvatura della cornea nei diversi archi per i 360° della sua circonferenza, determina
astigmatismo, cioè un difetto visivo che non permette una
nitida visione. Il suo potere medio è di circa 43 Diottrie.
La cornea è la prima lente naturale che la luce incontra, è determinante che sia trasparente e di forma più
o meno sferica. La diversa curvatura della cornea nei diversi archi per i 360° della sua circonferenza, determina
astigmatismo, cioè un difetto visivo che non permette una
nitida visione. Il suo potere medio è di circa 43 Diottrie. La cornea è una membrana trasparente priva di vasi ma ricchissima di fibre nervose.
Essa è bagnata continuamente dal film lacrimale che aderisce alla sua superficie anteriore ed è nutrita dall'umore acqueo cui trae contatti nella sua superficie posteriore.
L'interfaccia film lacrimale-superficie corneale costituisce la lente convergente più potente dell'occhio umano. La stabilità del film lacrimale e la trasparenza della cornea sono essenziali per la visione.
 La cornea ha uno spessore di circa 550 micron ed è composta dall'esterno all'interno da 5 strati:
La cornea ha uno spessore di circa 550 micron ed è composta dall'esterno all'interno da 5 strati: Epitelio Pavimentoso (stratificato)
Membrana di Bowmann
Lo Stroma
La membrana di Descemet
l'Endotelio
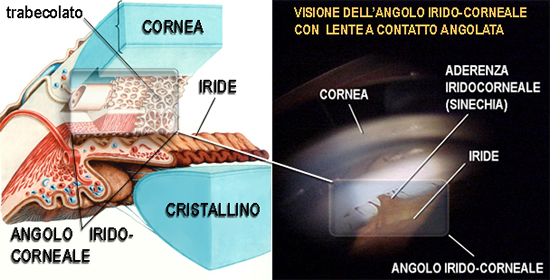
Iride e Pupilla
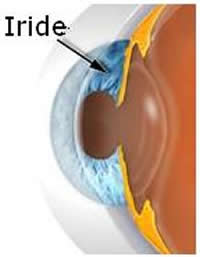 L'iride è la parte più anteriore dell'uvea che dà il colore ai nostri occhi e circonda un
piccolo foro centrale di ampiezza variabile da 2 a 8 mm : "la pupilla".
L'iride è la parte più anteriore dell'uvea che dà il colore ai nostri occhi e circonda un
piccolo foro centrale di ampiezza variabile da 2 a 8 mm : "la pupilla". L'iride e' composta da uno stroma, un foglietto pigmentato posteriore, da vasi e da 2 muscoli: il muscolo radiale (dilatatore) ed il muscolo sfintere (costrittore) dell'iride. Può essere chiara (dal blu al verde) o bruna (dal marrone al nero) ma in realtà la sua colorazione dipende sia dalla quantità di pigmento che da fenomeni ottici di riflessione e di diffrazione della luce nello stroma irideo.
Nelle iridi chiare poco pigmentate la luce passa fino agli strati profondi dove viene riflessa assumendo un colore chiaro. Al contrario nelle iridi brune, ricche di pigmento, la luce non penetra fino agli strati profondi e non viene riflessa né diffratta.
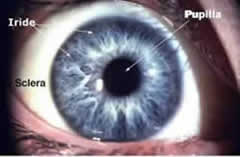 L'iride circonda la pupilla che si allarga o si restringe a seconda della quantità di luce che la raggiunge, agendo così
come il diaframma di una macchina fotografica che regola la quantità di luce che deve raggiungere la retina.
L'iride circonda la pupilla che si allarga o si restringe a seconda della quantità di luce che la raggiunge, agendo così
come il diaframma di una macchina fotografica che regola la quantità di luce che deve raggiungere la retina.Dietro l'iride c'è il cristallino o lente che delimita il segmento anteriore e che costituisce, quando diventa opaca, la struttura che è oggetto dell'intervento più frequente in oculistica : l'intervento di cataratta. In Italia si effettuano più di 500 mila interventi di cataratta l'anno.
Cristallino o Lente
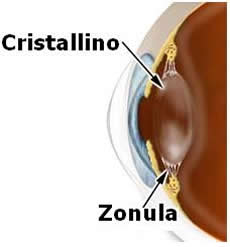 Il cristallino è una lente convergente di forma biconvessa che focalizza i raggi luminosi sulla retina.
Il cristallino è una lente convergente di forma biconvessa che focalizza i raggi luminosi sulla retina.Mentre in una macchina fotografica il fotografo mette a fuoco l'immagine variando la distanza focale fra lente e pellicola, nell'occhio la distanza tra il cristallino e la retina rimane fissa.
L'occhio mette a fuoco a distanze variabili con una strategia diversa: il cristallino ha la capacità di modificare continuamente la sua forma e di variare la sua curvatura in modo da aumentare o diminuire il suo potere di convergenza.
Questo processo dinamico così particolare, meglio conosciuto come accomodazione è regolato da un anello di fibre muscolari disposte intorno al cristallino chiamato corpo ciliare.
L'iride, il corpo ciliare e la coroide sono parte dell'uvea che le comprende tutte; così essa viene suddivisa topograficamente.
 Quando l'occhio guarda un oggetto in lontananza il cristallino si appiattisce e diminuisce la sua curvatura.
Quando l'occhio guarda un oggetto in lontananza il cristallino si appiattisce e diminuisce la sua curvatura.Al contrario quando guarda un oggetto vicino diventa più convesso ed aumenta la sua curvatura.
L'invecchiamento fa perdere sia al cristallino che al corpo ciliare il potere di accomodazione cosicché si diventa presbiti e non si è capaci di leggere a 30 cm.
In questo caso si ricorre alla correzione con lenti per vicino, bifocali o multifocali.
Inoltre è possibile la comparsa di opacità del cristallino ( cataratta ) che se sono centrali disturbano la visione.
Per ragioni di trasparenza ottica la cataratta si può operare e sostituire con una lentina artificiale (IOL).
La Retina
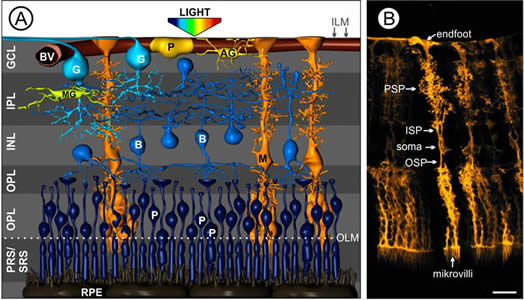 La retina, che rappresenta l'equivalente della pellicola fotografica, riveste la superficie interna del globo oculare.
La retina, che rappresenta l'equivalente della pellicola fotografica, riveste la superficie interna del globo oculare.
Essa appare come una sottile membrana trasparente suddivisa in due aree:
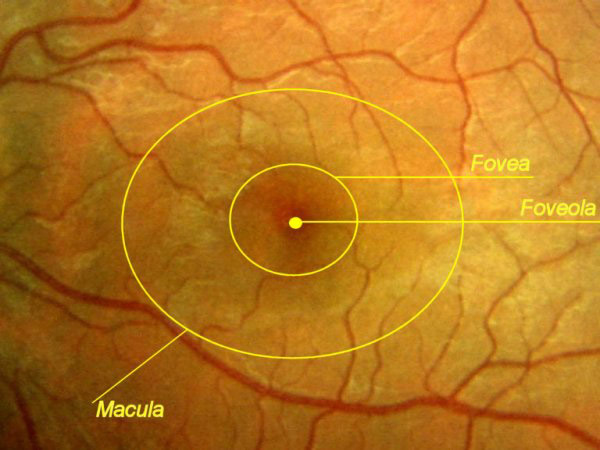
- un'area centrale chiamata macula che contiene la fovea centrale, ricca di coni;
- un'area media e periferica, dove prevalgono le cellule dei bastoncelli, che serve a mediare la visione crepuscolare e notturna.
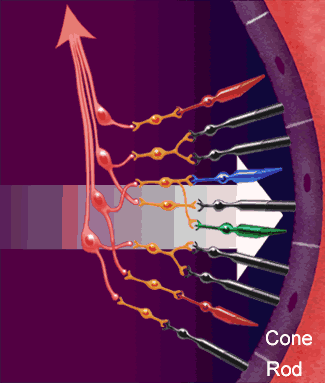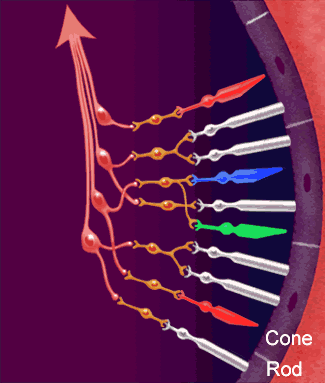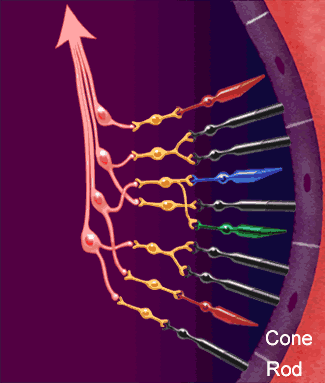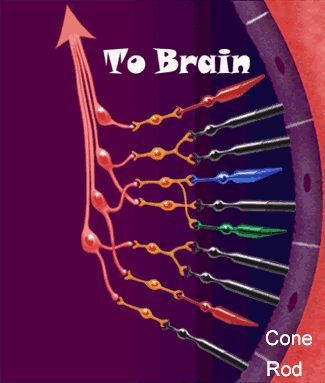 Dopo aver attraversato la cornea, la camera anteriore, la pupilla, il cristallino ed il vitreo, i raggi luminosi vengono
fatti convergere sulla retina ed in particolare in quella piccolissima area chiamata fovea centrale: una struttura
altamente specializzata che presiede, in condizioni di alta luminosità, alla massima acuità visiva per lontano e per vicino,
alla percezione dei colori ed alla sensibilità al contrasto.
Dopo aver attraversato la cornea, la camera anteriore, la pupilla, il cristallino ed il vitreo, i raggi luminosi vengono
fatti convergere sulla retina ed in particolare in quella piccolissima area chiamata fovea centrale: una struttura
altamente specializzata che presiede, in condizioni di alta luminosità, alla massima acuità visiva per lontano e per vicino,
alla percezione dei colori ed alla sensibilità al contrasto.
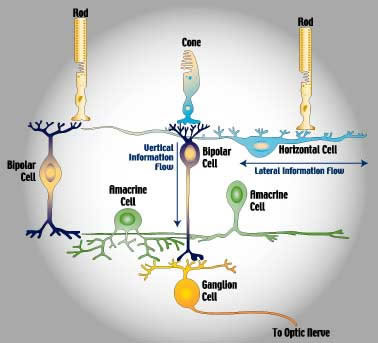 Nella retina avvengono i meccanismi più complessi della visione.
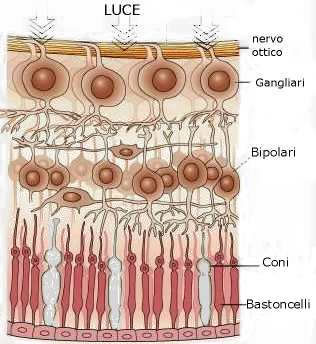
Nella retina avvengono i meccanismi più complessi della visione.La luce passa l'intero spessore della retina (vedi figura strati della retina) e colpisce immediatamente i fotorecettori.
Questi sono essenzialmente di due tipi:
I coni, più corti, localizzati quali esclusivamente nella parte centrale della retina (area maculare) sono specializzati alla visione in condizioni di alta luminosità, traggono contatti diretti con uno strato di cellule neuronali deputate alla trasmissione dell'impulso visivo.
Si viene a creare, quindi, una trasmissione di uno a uno cioè, un cono scarica il suo impulso con una sola cellula nervosa.
 Tale forma di collegamento è altamente strutturato e fa si che i coni siano deputati alla visione diurna, a quella dei
colori e del contrasto.
I bastoncelli, di forma più allungata, sono molto più numerosi dei coni e risiedono
maggiormente nella parte periferica della retina.
Tale forma di collegamento è altamente strutturato e fa si che i coni siano deputati alla visione diurna, a quella dei
colori e del contrasto.
I bastoncelli, di forma più allungata, sono molto più numerosi dei coni e risiedono
maggiormente nella parte periferica della retina. Essi sono più specializzati a raccogliere stimoli luminosi di bassa intensità e quindi sfruttati nella visione in condizioni di scarsa luminosità.
Più bastoncelli traggono contatti, cioè scaricano il proprio impulso, con una sola cellula neuronale sottostante venendo a creare un collegamento di molte cellule con una bipolare e ganglionare.
Ne consegue che lo stimolo generato non è così strutturato e preciso come quello dei coni.
Infatti la acutezza visiva cala notevolmente in condizioni di scarsa luminosità .
 L' Epitelio Pigmentato Retinico (EPR) è un monostrato cellulare che sta alla base della retina.
Questo è un vero è proprio schermo alle luce, impedendo il propagarsi della stessa agli strati sottostanti.
L' Epitelio Pigmentato Retinico (EPR) è un monostrato cellulare che sta alla base della retina.
Questo è un vero è proprio schermo alle luce, impedendo il propagarsi della stessa agli strati sottostanti.Oltre ad avere questo effetto schermo è di fondamentale importanza negli scambi metabolici tra i fotorecettori (coni e bastoncelli) e la coroide sottostante.
La sua integrità è, quindi, condizione essenziale per il buon funzionamento del complesso equilibrio retinico.
Infatti in molte patologie retiniche viene interessato proprio questo strato.
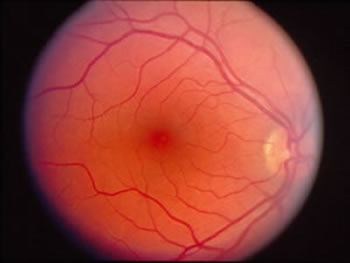 Quante volte è capitato di trovare patologie gravi e doverle comunicare al paziente ed al medico curante: una
retinopatia diabetica, o una leucemia
cronica, o un'ipertensione endocranica e via dicendo.
Quante volte è capitato di trovare patologie gravi e doverle comunicare al paziente ed al medico curante: una
retinopatia diabetica, o una leucemia
cronica, o un'ipertensione endocranica e via dicendo.Anche gravi intossicazioni o insufficienze renali acute possono dare come primo sintomo un segno oculare eclatante.
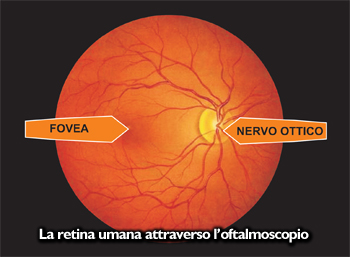 E' estremamente importante studiare l'aspetto di tutte le strutture retiniche presenti
all'esame del fondo oculare:
i vasi arteriosi e venosi, la papilla ottica o disco ottico, la macula e la restante retina periferica.
E' estremamente importante studiare l'aspetto di tutte le strutture retiniche presenti
all'esame del fondo oculare:
i vasi arteriosi e venosi, la papilla ottica o disco ottico, la macula e la restante retina periferica.Da un attento esame l'oculista può stabilire sia lo stato funzionale retinico che capire se sono presenti patologie generali che possono essere spesso misconosciuti al paziente.
Müller Cells as Players in Retinal Edema
Di Andreas Bringmann, MDScarica il pdf
Macular edema is a major cause of vision loss.
The accumulation of water within the macular tissue and in the subretinal space is associated with functional impairment of photoreceptors and retinal neurons.
Water may accumulate within retinal cells (cytotoxic edema characterized by cellular swelling) and in interstitial spaces (extracellular edema resulting in cell compression). Systemic and retinal factors may contribute to the development of macular edema.
Systemic disorders result in inflow of excess water from the blood into the retinal tissue, either by increase in hydrostatic pressure (hypertension) or decrease in blood osmolarity (eg, in cases of hyponatremia and hypoalbuminemia).
(Fig.1) Main retinal factors are ischemia-hypoxia (associated with oxidative stress) and local inflammation.
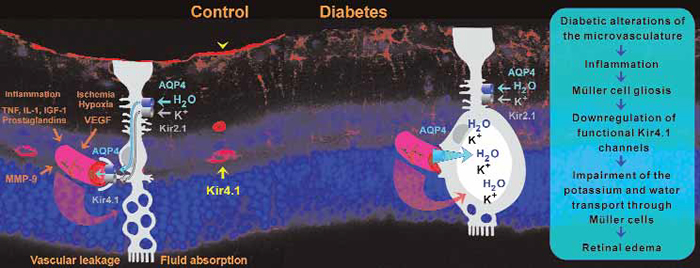
Figure 1. Disruption of Müller cell-mediated fluid clearance and (under certain conditions) Müller cell swelling may contribute
to the development of diabetic retinal edema. In a rat model of diabetic retinopathy, the major potassium channel of Müller
cells (Kir4.1), which is normally expressed around the retinal vessels (yellow arrow) and at the inner limiting membrane (yellow
arrowhead) is downregulated.This disrupts the water transport through the cells, which is facilitated by water channels (AQP4),
and coupled to potassium currents through potassium channels (Kir2.1,Kir4.1).Accumulation of potassium within the cells
increases the intracellular osmotic pressure, resulting in water influx into the cells and cellular swelling.
VASCULAR LEAKAGE VS IMPAIRMENT IN FLUID CLEARANCE
Retinal ischemia-hypoxia and inflammation are associated with release of factors that promote breakdown of the blood-retinal barrier (vascular endothelial growth factor [VEGF], various inflammatory factors, and matrix-metalloproteinases).
Blood-derived fluid moves across the leaky pigment epithelium and vessel walls into the tissue (vasogenic edema).
Generally, water accumulation within the retinal tissue results from an imbalance between the rate of fluid inflow into the retinal tissue and the rate of fluid absorption from the retina into the blood.
It has been suggested that anomalies in vessel permeability must be accompanied by ineffective edema-resolving mechanisms to result in chronic edema.
An impairment in the fluid-clearance mechanisms is a major cause of macular edema in patients without angiographic vascular leakage.
Diabetic macular edema develops when the active transport mechanisms of the blood-retinal barrier are dysfunctional.
Retinal ischemia-hypoxia and inflammation are associated with release of factors that promote breakdown of the blood-retinal barrier (vascular endothelial growth factor [VEGF], various inflammatory factors, and matrix-metalloproteinases).
Blood-derived fluid moves across the leaky pigment epithelium and vessel walls into the tissue (vasogenic edema).
Generally, water accumulation within the retinal tissue results from an imbalance between the rate of fluid inflow into the retinal tissue and the rate of fluid absorption from the retina into the blood.
It has been suggested that anomalies in vessel permeability must be accompanied by ineffective edema-resolving mechanisms to result in chronic edema.
An impairment in the fluid-clearance mechanisms is a major cause of macular edema in patients without angiographic vascular leakage.
Diabetic macular edema develops when the active transport mechanisms of the blood-retinal barrier are dysfunctional.
FLUID ABSORPTION FROM THE RETINAL TISSUE
Under normal conditions, water accumulates in the retinal tissue due to various reasons, including the uptake of nutrients from the blood, which is associated with water inflow into the tissue, and the production of water in the course of aerobic energy production.
(The oxidative breakdown of one molecule of glucose results in the formation of 42 molecules of water.)
The accumulation of metabolic water is strongest in the macular tissue because of the high density of highly metabolically active photoreceptors.
Of all the cells of the body, photoreceptor cells probably have the highest rate of oxidative metabolism.
There is a continuous redistribution of metabolic water from the retinal tissue into the blood carried out by Müller cells, which dehydrate the retinal parenchyma, and pigment epithelial cells, which dehydrate the subretinal space.
The water transport through Müller and pigment epithelial cells is osmotically driven by transcellular currents of osmolytes, especially of potassium ions.
To facilitate the transport process, the cells express potassium- and water-selective channels (aquaporins) in their membranes.
DYSFUNCTION OF MÜLLER CELLS
Chronic macular edema is characterized by an impairment in the fluid clearance from the retinal tissue.
Because Müller cells dehydrate the retinal tissue, we determined the properties of the cells in animal models of various retinopathies known to be associated with development of edema (eg, ischemia,4 ocular inflammation, diabetes,5 and blue-light evoked retinal degeneration).
6 We found that in all these cases the potassium currents across the Müller cell membranes are strongly decreased due to the downregulation of potassium channels, which are normally localized to Müller cell membranes that surround the blood vessels.
An impairment of the potassium transport through Müller cells should also disrupt the regular osmotically driven water transport through the cells and, thus, the fluid clearance from the retinal tissue. We investigated the water transport across Müller cell membranes in osmotic cell swelling experiments.
We found that Müller cells in tissue slices of pathologically altered retinas displayed cellular swelling during superfusion with a hypoosmolar solution, whereas Müller cells of control retinas do not swell under such osmotic stress conditions.
The swelling of Müller cells, which is not seen under normal conditions, reflects an alteration in the water transport through the cells. The results suggest that a disturbance in the potassium and water transport through Müller cells contributes to the development of retinal edema.
Are these results applicable to the human situation? We found in preliminary experiments using retinal tissues from patients with choroidal melanoma that Müller cells with reduced potassium currents display osmotic swelling, while cells with normal potassium currents do not swell under osmotic stress conditions.
An age-related decrease in potassium channel expression of human Müller cells7 may contribute to the higher incidence of macular edema in the elderly.
In cases of macular edema caused by systemic disorders, a considerable amount of water that flows into the retinal parenchyma will directly move into the Müller cells, because the perivascular processes of Müller cells fill most of the space around the blood vessels.
Under these conditions, the water flow from the blood into the tissue may overtax the capability of Müller cells to clear the retina from excess water.
MÜLLER CELL SWELLING
Impaired fluid clearance may result in cytotoxic edema characterized by cellular swelling.
In the ischemic retina, both a rapid neuronal cell swelling and a slow Müller cell swelling were suggested to contribute to the thickening of the retinal tissue.
Swelling of retinal neurons follows from malfunction of mitochondria caused by reactive oxygen radicals, which results in dysfunctional ion transport across the neuronal membranes and a sustained activation of ionotropic receptors due to pathological increase in extracellular glutamate.
Müller cell swelling results from the downregulation of potassium channels through which the cells normally extrude potassium into the blood vessels.
Because the cells are capable of taking up excess potassium from the retinal interstitium but are unable to release the ions, potassium accumulates within the cells; the increase in the intracellular osmotic pressure will cause an osmotic influx of water from the blood into the cells, resulting in cellular swelling.
We found that various other factors that are known to contribute to edema formation, such as oxidative stress and inflammatory factors like prostaglandins, contribute to the induction of Müller cell swelling.
It remains to be determined, however, whether Müller cell swelling really contributes to the development of edema.
In animal models of retinal hypoxia, vascular leakage is accompanied by cellular edema of Müller cells.
Some previous electron microscopic studies suggest that in addition to ischemic changes in the retinal microvasculature, swelling of Müller cells contributes to the development of cystoid macular edema, with the cysts being formed by swollen and necrotic Müller cells, while other studies do not describe swollen Müller cells.
In the brain, swelling of astrocytes (especially of their perivascular processes) usually occurs concomitantly in vasogenic edema.
Most likely, the relative contribution of vasogenic edema and dysfunction of Müller cells to the formation of retinal edema varies in dependence on the specific conditions in individual patients.
STIMULATION OF FLUID CLEARANCE BY TRIAMCINOLONE ACETONIDE?
Resolution of retinal edema can be obtained by reducing the fluid inflow from the blood and by stimulation of the fluid clearance from the retinal tissue.
The antiinflammatory steroid triamcinolone acetonide reduces vascular leakage via several mechanisms, including inhibition of the production and release of VEGF, inflammatory factors, and matrix metalloproteinases.
We found that triamcinolone acetonide inhibits the osmotic swelling of Müller cells.
Triamcinolone acetonide stimulates the release of endogenous adenosine from the retinal tissue; adenosine activates adenosine A1 receptors, which results in the opening of potassium channels in the Müller cell membranes.
The outflow of potassium ions from the cells balances the osmotic gradient across the membranes and thus prevents cellular swelling. In swollen cells, the outflow of potassium ions is associated with an efflux of water, resulting in shrinkage of the cells.
We suggest that triamcinolone acetonide stimulates the fluid absorption from the retinal tissue because opening of ion channels in Müller cell membranes improves the transport of osmolytes and, thus, of water through the cells.
The observation that triamcinolone acetonide resolves macular edema also in patients who do not display angiographic vascular leakage suggests that it stimulates the fluid absorption from the retinal tissue.
Selective pharmacologic activation of A1 receptors may represent a method for rapid resolution of retinal edema.
A similar resolution of subretinal edema can be achieved by pharmacologic activation of purinergic receptors on retinal pigment epithelial cells.
Release of endogenous adenosine and subsequent activation of A1 receptors is an important component of the retinal response to ischemic-hypoxic stress.
Adenosine protects retinal neurons from hyperexcitation and glutamate toxicity.
This effect will also prevent the glutamate-evoked swelling of retinal neurons as another component of edema formation.
Under normal conditions, water accumulates in the retinal tissue due to various reasons, including the uptake of nutrients from the blood, which is associated with water inflow into the tissue, and the production of water in the course of aerobic energy production.
(The oxidative breakdown of one molecule of glucose results in the formation of 42 molecules of water.)
The accumulation of metabolic water is strongest in the macular tissue because of the high density of highly metabolically active photoreceptors.
Of all the cells of the body, photoreceptor cells probably have the highest rate of oxidative metabolism.
There is a continuous redistribution of metabolic water from the retinal tissue into the blood carried out by Müller cells, which dehydrate the retinal parenchyma, and pigment epithelial cells, which dehydrate the subretinal space.
The water transport through Müller and pigment epithelial cells is osmotically driven by transcellular currents of osmolytes, especially of potassium ions.
To facilitate the transport process, the cells express potassium- and water-selective channels (aquaporins) in their membranes.
DYSFUNCTION OF MÜLLER CELLS
Chronic macular edema is characterized by an impairment in the fluid clearance from the retinal tissue.
Because Müller cells dehydrate the retinal tissue, we determined the properties of the cells in animal models of various retinopathies known to be associated with development of edema (eg, ischemia,4 ocular inflammation, diabetes,5 and blue-light evoked retinal degeneration).
6 We found that in all these cases the potassium currents across the Müller cell membranes are strongly decreased due to the downregulation of potassium channels, which are normally localized to Müller cell membranes that surround the blood vessels.
An impairment of the potassium transport through Müller cells should also disrupt the regular osmotically driven water transport through the cells and, thus, the fluid clearance from the retinal tissue. We investigated the water transport across Müller cell membranes in osmotic cell swelling experiments.
We found that Müller cells in tissue slices of pathologically altered retinas displayed cellular swelling during superfusion with a hypoosmolar solution, whereas Müller cells of control retinas do not swell under such osmotic stress conditions.
The swelling of Müller cells, which is not seen under normal conditions, reflects an alteration in the water transport through the cells. The results suggest that a disturbance in the potassium and water transport through Müller cells contributes to the development of retinal edema.
Are these results applicable to the human situation? We found in preliminary experiments using retinal tissues from patients with choroidal melanoma that Müller cells with reduced potassium currents display osmotic swelling, while cells with normal potassium currents do not swell under osmotic stress conditions.
An age-related decrease in potassium channel expression of human Müller cells7 may contribute to the higher incidence of macular edema in the elderly.
In cases of macular edema caused by systemic disorders, a considerable amount of water that flows into the retinal parenchyma will directly move into the Müller cells, because the perivascular processes of Müller cells fill most of the space around the blood vessels.
Under these conditions, the water flow from the blood into the tissue may overtax the capability of Müller cells to clear the retina from excess water.
MÜLLER CELL SWELLING
Impaired fluid clearance may result in cytotoxic edema characterized by cellular swelling.
In the ischemic retina, both a rapid neuronal cell swelling and a slow Müller cell swelling were suggested to contribute to the thickening of the retinal tissue.
Swelling of retinal neurons follows from malfunction of mitochondria caused by reactive oxygen radicals, which results in dysfunctional ion transport across the neuronal membranes and a sustained activation of ionotropic receptors due to pathological increase in extracellular glutamate.
Müller cell swelling results from the downregulation of potassium channels through which the cells normally extrude potassium into the blood vessels.
Because the cells are capable of taking up excess potassium from the retinal interstitium but are unable to release the ions, potassium accumulates within the cells; the increase in the intracellular osmotic pressure will cause an osmotic influx of water from the blood into the cells, resulting in cellular swelling.
We found that various other factors that are known to contribute to edema formation, such as oxidative stress and inflammatory factors like prostaglandins, contribute to the induction of Müller cell swelling.
It remains to be determined, however, whether Müller cell swelling really contributes to the development of edema.
In animal models of retinal hypoxia, vascular leakage is accompanied by cellular edema of Müller cells.
Some previous electron microscopic studies suggest that in addition to ischemic changes in the retinal microvasculature, swelling of Müller cells contributes to the development of cystoid macular edema, with the cysts being formed by swollen and necrotic Müller cells, while other studies do not describe swollen Müller cells.
In the brain, swelling of astrocytes (especially of their perivascular processes) usually occurs concomitantly in vasogenic edema.
Most likely, the relative contribution of vasogenic edema and dysfunction of Müller cells to the formation of retinal edema varies in dependence on the specific conditions in individual patients.
STIMULATION OF FLUID CLEARANCE BY TRIAMCINOLONE ACETONIDE?
Resolution of retinal edema can be obtained by reducing the fluid inflow from the blood and by stimulation of the fluid clearance from the retinal tissue.
The antiinflammatory steroid triamcinolone acetonide reduces vascular leakage via several mechanisms, including inhibition of the production and release of VEGF, inflammatory factors, and matrix metalloproteinases.
We found that triamcinolone acetonide inhibits the osmotic swelling of Müller cells.
Triamcinolone acetonide stimulates the release of endogenous adenosine from the retinal tissue; adenosine activates adenosine A1 receptors, which results in the opening of potassium channels in the Müller cell membranes.
The outflow of potassium ions from the cells balances the osmotic gradient across the membranes and thus prevents cellular swelling. In swollen cells, the outflow of potassium ions is associated with an efflux of water, resulting in shrinkage of the cells.
We suggest that triamcinolone acetonide stimulates the fluid absorption from the retinal tissue because opening of ion channels in Müller cell membranes improves the transport of osmolytes and, thus, of water through the cells.
The observation that triamcinolone acetonide resolves macular edema also in patients who do not display angiographic vascular leakage suggests that it stimulates the fluid absorption from the retinal tissue.
Selective pharmacologic activation of A1 receptors may represent a method for rapid resolution of retinal edema.
A similar resolution of subretinal edema can be achieved by pharmacologic activation of purinergic receptors on retinal pigment epithelial cells.
Release of endogenous adenosine and subsequent activation of A1 receptors is an important component of the retinal response to ischemic-hypoxic stress.
Adenosine protects retinal neurons from hyperexcitation and glutamate toxicity.
This effect will also prevent the glutamate-evoked swelling of retinal neurons as another component of edema formation.
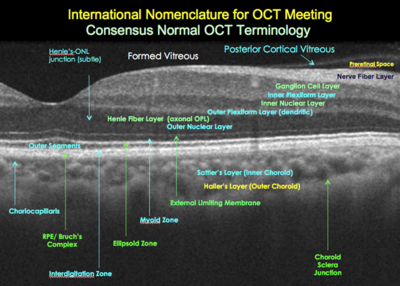
Nuova Nomenclatura OCT
Autofluorescenza
da eoculistica.itProprietà ottiche della lipofuscina
Le caratteristiche spettrali della lipofuscina vengono utilizzate per registrare in vivo l'AF del fondo oculare.Studi di analisi spettrofotometrica hanno dimostrato che il picco massimo di assorbimento e di emissione della lipofuscina è compreso tra 488 e 695 nm. L'assorbimento è massimo nella luce blu, mentre l'emissione nella regione rosso-arancio.
Autofluorescenza
Storicamente, l'autofluorescenza del fondo oculare descriveva la capacità di alcune lesioni retiniche di emettere iperfluorescenza anche in assenza di iniezione di fluorescina.Le lesioni retiniche in grado di emettere autofluorescenza sono i corpi colloidi della testa del nervo ottico e gli amartomi astrocitici.
Oggi sappiamo che l'autofluorescenza è indice della presenza di accumuli di lipofuscina nelle cellule dell'epitelio pigmentato retinico e viene utilizzata clinicamente per la valutazione in vivo dell'EPR mediante sistemi che sfruttano una lunghezza d'onda di eccitazione in uscita di 488 nm ed un filtro per lunghezze d'onda inferiori a 500 nm in ingresso.
 La presenza di lipofuscina è aumentata in quei quadri patologici che presentano un accelerato metabolismo della neuroretina
o un deficit di smaltimento delle lipofuscine da parte dell'epitelio pigmentato. Valutando lo stato di salute dell'epitelio
pigmentato è quindi un valido metodo per riconoscere patologie retiniche prima che si manifestino clinicamente.
La presenza di lipofuscina è aumentata in quei quadri patologici che presentano un accelerato metabolismo della neuroretina
o un deficit di smaltimento delle lipofuscine da parte dell'epitelio pigmentato. Valutando lo stato di salute dell'epitelio
pigmentato è quindi un valido metodo per riconoscere patologie retiniche prima che si manifestino clinicamente. La A2E è in grado di indurre la morte programmata dell'EPR, se questo accumulo è abnorme può verificarsi una accelerazione dell'apoptosi dell'EPR.
I primi segni della degenerazione maculare legata all'età (AMD) di tipo atrofico sono la comparsa di aree focali di atrofia dell'EPR e della sovrastante neuroretina che sorgono in aree parafoveali e che tendono ad ingrandirsi progressivamente.
Funzionalmente ciò si traduce in una riduzione lieve-moderata dell'acuità visiva con difficoltà nella lettura e comparsa di scotomi assoluti nelle aree di atrofia.
Come precedentemente detto, l'autofluorescenza del fondo oculare può essere di aiuto nel fornire informazioni sullo stato di salute dell'EPR.
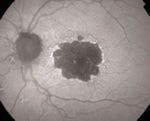 Fasi iniziali: le alterazioni primitive della AMD sono costituite dalla comparsa di hard o
soft drusen, di alterazioni pigmentarie di diversa forma ed estensione e dalla presenza di aree focali
di atrofia dell'EPR.
Fasi iniziali: le alterazioni primitive della AMD sono costituite dalla comparsa di hard o
soft drusen, di alterazioni pigmentarie di diversa forma ed estensione e dalla presenza di aree focali
di atrofia dell'EPR.AMD atrofica: caratterizzata dalla presenza in regione maculare di aree di atrofia dell'EPR, della retina neurosensoriale (sovrastante) e della coriocapillare, della quale di vendono visibili i grossi vasi.
L'autofluorescenza evidenzia una zona d ipo-autofluorescenza centrale, circondata da un bordo con iper-autofluorescenza di intensità variabile, segno di sofferenza tissutale retinica con iniziale danno dell'EPR e probabile futura atrofia.
Il pattern della iper-autofluorescenza periatrofica può essere lineare oppure reticolare o granulare diffuso con presenza di spot al polo posteriore. La progressione sembra meno aggressiva quanto l'iper-autofluorescenza è confinata al solo perimetro giunzionale.
torna al menù
Fotografia del fondo oculare (lingua spagnola)
 Fotografia del fondo oculare
Fotografia del fondo ocularea cura del dott. Gili Manzarano - Unità di oftamologia, ospedale Alcorcòn, Madrid
torna al menù
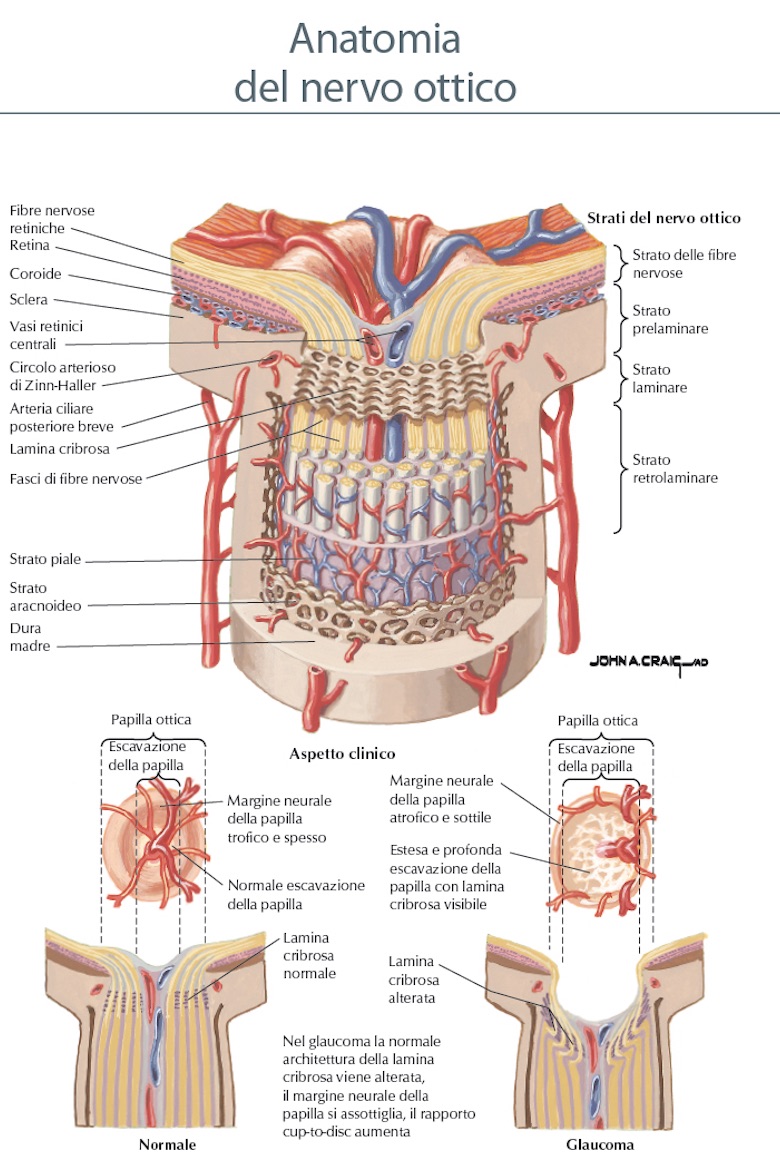
Nervo Ottico
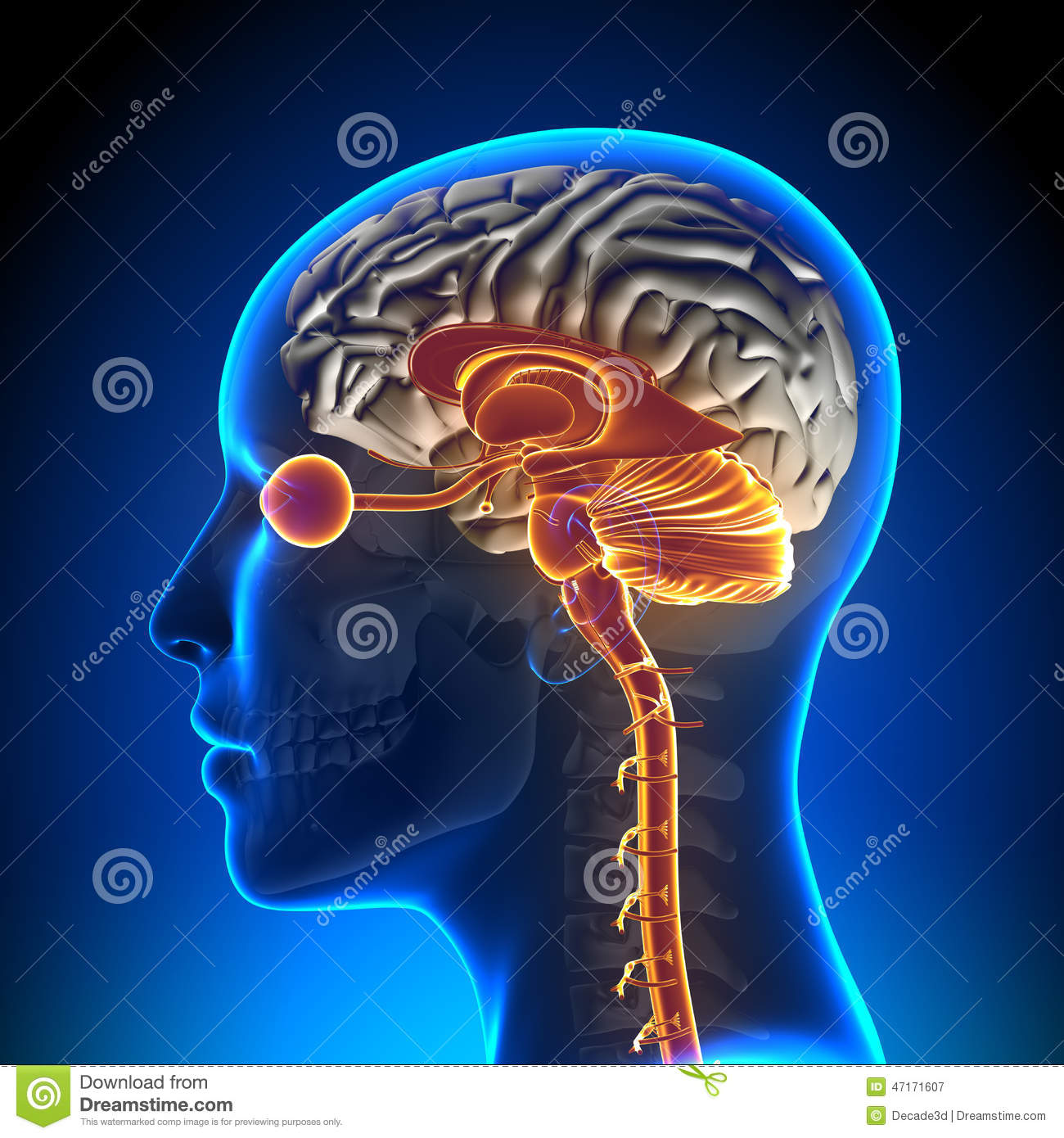
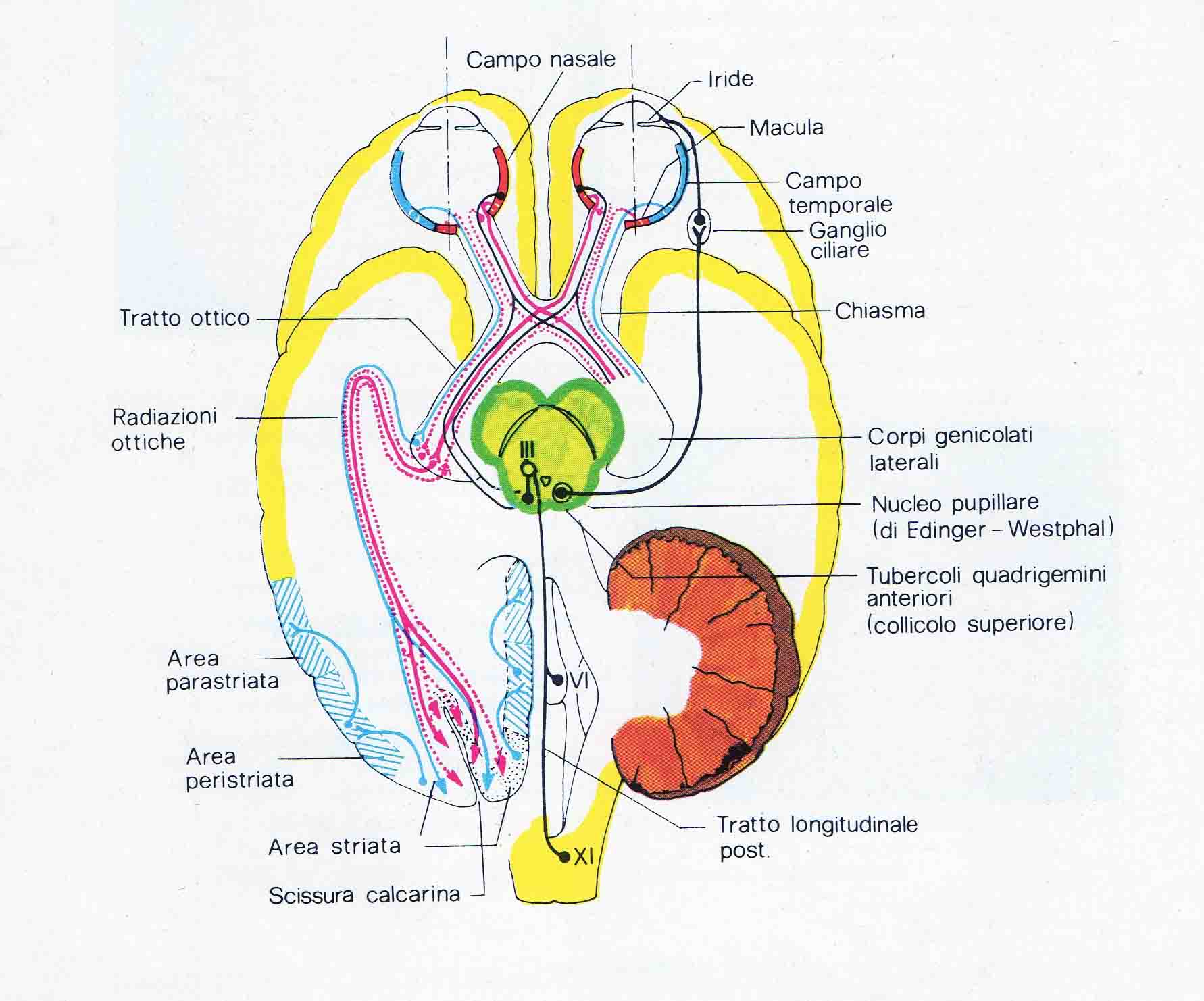
Il nervo ottico è un nervo sensitivo non paragonabile agli altri nervi craniali, poiché per lo sviluppo e la struttura appartiene al cervello e deve essere considerato come un fascio centrale intercerebrale. Le fibre nervose si trovano nel bulbo oculare, metà di queste si trovano sul lato temporale, mentre l’altra metà sul lato nasale. Dalla papilla, che si trova sul lato posteriore del bulbo, fuoriescono circa un milione di fibre che formano il nervo ottico. Assieme al nervo fuoriescono anche l’arteria e la vena centrale della retina. Metà delle fibre del nervo ottico (fasciculus opticus) si incrociano al chiasma ottico, in questa maniera quelle fibre che vengono dal lato temporale della retina non incrociano, mentre quelle dal lato del naso passano alla parte opposta. Malgrado l’incrocio parziale, la disposizione somatotopica è rigorosamente mantenuta fino alla corteccia visiva. Dal chiasma le fibre raggiungono il corpo genicolato del talamo e da qui raggiungono le aree visive della corteccia del lobo occipitale.Funzione del Nervo Ottico
Il nervo ottico trasmette le informazioni visive al cervello e questo avviene tramite la retina dell’occhio dove si trovano i coni e i bastoncelli i quali provocano una reazione foto-chimica che a sua volta fa scattare degli impulsi che vengono trasmessi alla corteccia visiva del cervello. Già nel primo mese di vita embrionale si crea una protuberanza del cervello, la quale crea la base per lo sviluppo del fascicolo ottico, la retina, l’epitelio pigmentato ed il corpo vitreo i quali sono collegati con il diencefalo. Questi tre strati si differenziano fra di loro: dal tubo neurale si forma la retina dall’ectoderma si forma la cornea e la lente dal mesoderma si forma la coroidea, la sclera ed il corpo vitreo. Sviluppo dell’occhio nel tempo: - nella terza settimana dallo sviluppo embrionale si differenziano due protuberanze dal diencefalo, - nella quarta settimana si sviluppano due vescicolette con uno stelo che diventerà il nervo ottico, - nella quinta settimana le vescicolette si trasformeranno in due strati, quello esterno che diventerà l’epitelio pigmentato e quello interno che diventerà retina e tunica interna. Nel momento della nascita la retina è sviluppata solo parzialmente. Lo sviluppo completo avviene solo dal secondo fino al quarto anno di età. Il nervo ottico deve attraversare tre strati importanti dell’occhio: tunica esterna o bulbo che corrisponde alla dura mater delcervello, tunica media, tunica interna che è la retina. Passaggio dalla base cranica il nervo ottico lascia la cavità oculare insieme all’arteria oftalmica dal canale ottico.Funzione nervo della vista
Patologie
Alcune malattie possono compromettere la funzione del nervo ottico: infarto del nervo ottico causato da disturbi microvascolari nella ipertensione o nel diabete mellitus, glaucoma , aumento della pressione del bulbo oculare, infezioni virali come la varicella, herpes zoster, orecchioni con conseguente neuriti al nervo ottico, spesso come manifestazione primaria nella sclerosi multipla, sintomi di vista velata fino alla cecità, tumori, emorragie.Esame clinico
Il controllo del nervo ottico fa parte della visita neurologica che consiste in tre esami: esame neuro oftalmico che consiste nel controllo della vista ad ogni singolo occhio, rivelazione dei difetti del campo visivo e la campimetria che registra il campo visivo centrale a partire dal punto di fissazione fino ad un angolo di 30 gradi.Possibilità terapeutiche
È importante considerare la possibile interferenza con la funzione del sistema visivo dovuta ad una pressione o a un’infiammazione delle cellule aeree dei seni sfenoidali e etmoidali, o ad un ingrossamento della ghiandola pituitaria. Si deve tenere presente che il rivestimento periosteo dell’orbita è in continuità con la dura madre della cavità craniale; pertanto, una tensione anormale sulla dura madre nel cranio può avere delle ripercussioni sull’orbita e viceversa. Così si giunge alla inevitabile conclusione che le tensioni normali della membrana durale e la mobilità dello sfenoide sono requisiti essenziali per un buon funzionamento del sistema visivo. La mobilità dell’osso occipitale e temporale sono parimenti essenziali per ottenere una tensione normale sul tentorio. Anche un buon funzionamento dell’apparato muscolo-scheletrico, specialmente a livello delle cervicali superiori e del sacro, dove ci sono gli innesti ossei della dura, è essenziale per un funzionamento normale del sistema visivo.torna al menù
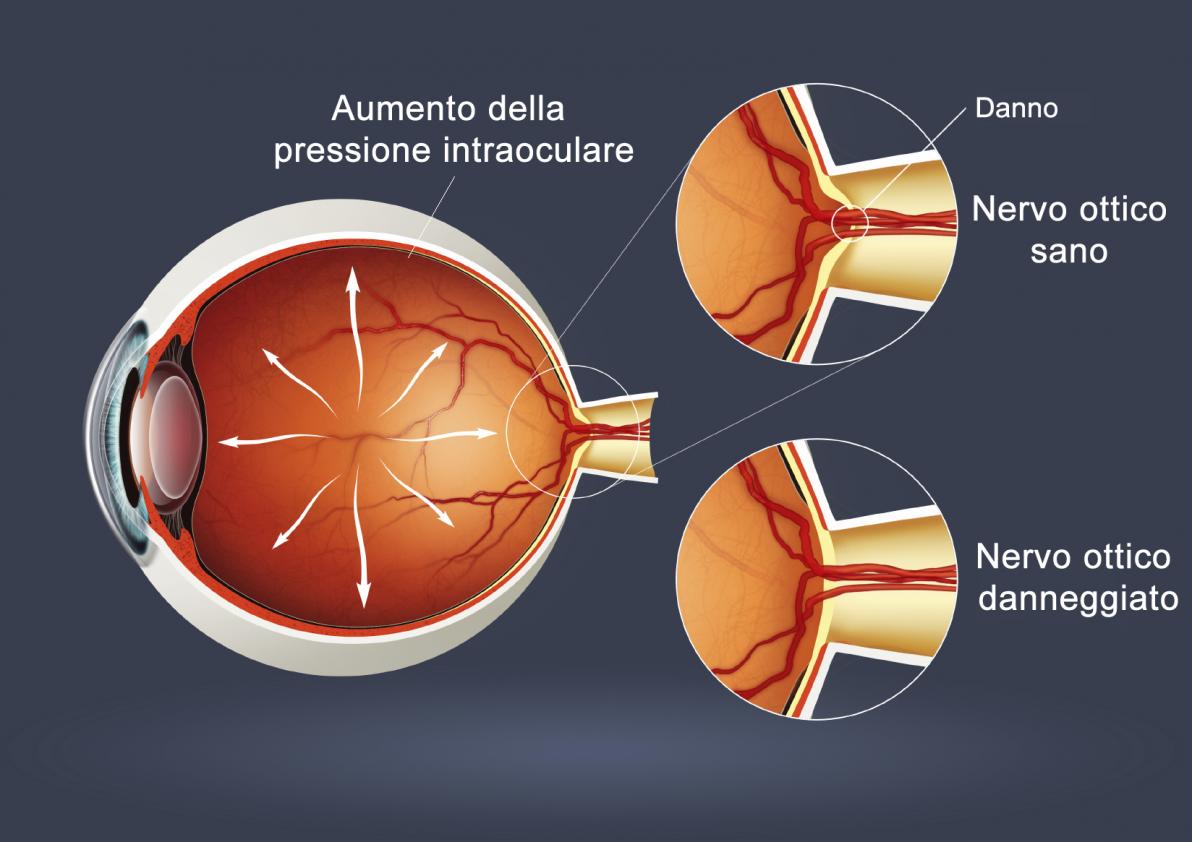
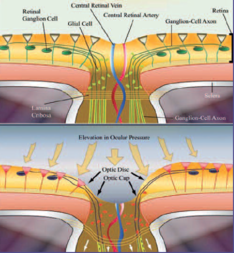
Lamina Cribrosa
 La Lamina Cribrosa : imaging e biomeccanica di Amedeo Lucente
La Lamina Cribrosa : imaging e biomeccanica di Amedeo Lucente
La lamina cribrosa LC fa parte del tessuto sclerale. E' la sede anatomica dove si ritiene avvenga il danno da IOP elevata agli assoni delle cellule ganglionari retiniche RGC Retinal Ganglion Cells (Fig. 1a, 1b). Con l’avvento dei nuovi device Hi-Tech la LC è oggetto di rinnovati e interessanti studi. Marian Wilczen, oftalmologo di Cracovia, nel fondamentale lavoro del 1947 "De lamina cribrosa and its nature", facendo propri gli studi di E. Fuchs, la descrive per la prima volta in modo completo, dettagliato e impareggiabile. Ernst Fuchs (1851,Kritzendorf - 1930, Vienna), un secolo fa, nel 1916, definì questa struttura: Il rinnovato interesse che le nuove tecnologie d'imaging, segnatamente gli SD-OCT, mostrano per la LC, è giustificato dall’evidenza del rapporto di causalità tra i cambiamenti strutturali che questa struttura subisce in corso di glaucoma , e il conseguente danno neuronale e funzionale. Numerosi studi istologici su occhi di scimmie con glaucoma sperimentalmente indotto hanno dimostrato un arretramento della LC nel canale sclerale [7]. Uno spostamento posteriore della LC è stato d'altra parte osservato anche in occhi di donatori umani sani e glaucomatosi, dopo elevazione artificiale della IOP. L’arretramento della LC, la formazione dell’escavazione della testa del nervo ottico ONH Optic Nerve Head, e le alterazioni anatomiche dell’area della rima neurale RA Rim Area per aumento della IOP, sono problematiche biomeccaniche ancora non chiarite pienamente, oggetto di rinnovate riflessioni con l’ausilio degli SD-OCT e, da poco tempo, con gli SS-OCT SweptSource.
Importanti miglioramenti dell'imaging sono inoltre in arrivo con l’utilizzo delle ottiche adattive o adattative AO Adaptive Optics, indispensabili per mi-gliorare la risoluzione finale tomografica, e il rapporto segnale/rumore SNR Signal to Noise Ratio, fondamentali nell’ottenere una migliore definizione, specialmente nell’imaging tridimensionale 3D. Quest'articolo cercherà brevemente di tracciare il profilo delle più innovative linee di ricerca sulla LC, gli aspetti clinici, biomeccanici e d’imaging di questa struttura, le prospettive diagnostiche e terapeutiche che i nuovi device stanno aprendo nel management e follow-up del glaucoma.
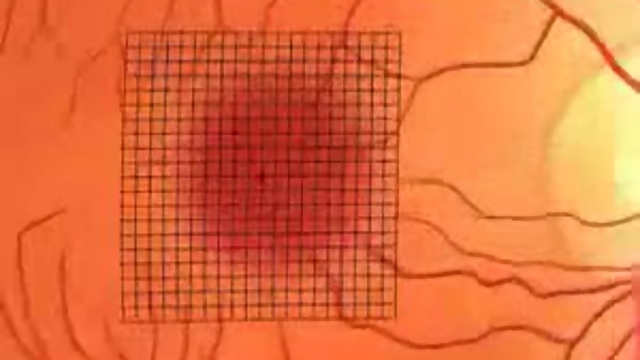
Test di Amsler Multicolor (di Amedeo Lucente)
 Test di Amsler Red e Multicolor di Amedeo Lucente
Test di Amsler Red e Multicolor di Amedeo Lucente
Il test di Amsler è costituito da un foglio a quadretti con sfondo nero e righe bianche delle dimensioni di 10X10 cm contenente 400 quadratini.
Spesso viene divulgato dalle case farmaceutiche con sfondo bianco e linee nere, ma in questa veste è meno efficace, come dimostrato da lavori scientifici. Viene effettuato con la correzione per vicino e con un occhio per volta, chiedendo al paziente se le righe e i quadretti sono visti tutti in modo omogeneo o deformato.
Bisogna avere pazienza nell'eseguirlo perché spesso il paziente può non comprendere e riferire con difficoltà una visione deformata, anche se è presente, per problemi psicologici, perché la distanza di esecuzione del test è sbagliata, l'illuminazione è debole o troppo intensa e/o messa di taglio rispetto al cartoncino o perché, infine, il cartoncino è messo non perpendicolare all'asse visivo.
Da molto tempo uso il test con una variante non molto conosciuta, ora presente anche nelle nuove tabelle ottotipiche a monitor, che stanno sostituendo i vecchi tabelloni ottotipici retroilluminati.
La variante è a sfondo nero con linee rosse (Amsler Rosso). In questo modo si riesce prima ad individuare le defomazioni soggettive in presenza di alterazioni della retina esterna, epitelio pigmentato EPR e coni centrali, più spesso coinvolti nelle maculopatie senili.
L'uso di questa variante del test classico ha un supporto scientifico, trovato in letteratura nelle malattie reumatiche per l'uso di idrossiclorochina in corso di artrite reumatoide. La mia esperienza di alcuni anni ormai mi ha fatto verificare la validità predittiva del test di Amsler Rosso e invito i colleghi a provare e verificarne l'efficacia.
In caso di cataratta, per migliorare il contrasto, esiste una variante a sfondo blu e righe gialle, Amsler Blu/Giallo, che più sensibilmente permette in caso di opacità dei mezzi diottrici di dare la possibilità di individuare risposte positive da parte dei pazienti.
Inoltre è possibile avere test di Amsler con forma circolare o a doppi quadrati, gli interni centrali più piccoli e i periferici di grandezza standard, per verificare alterazioni topografiche retiniche altrimenti non soggettivamente rilavabili, o avere test di linearità verticali o orizzontali, che semplificano la risposta in pazienti incerti, ma patologici. Provare tutte queste possibilità di lettura del test è onerosa per il tempo dell'esecuzione, ma efficace per evidenziare le prime deformazioni metamorfopsiche.
Far eseguire ai pazienti a casa gli Amsler modificati per accorciare i controlli periodici può risultare utile nella prognosi a lungo tempo. Da tempo ho riferito di questi test di Amsler modificati a numerose case farmaceutiche, che farebbero cosa gradita e utile nel distribuire queste varianti, con costi del resto irrisori, anche per allargare l'esperienza sul campo e verificarne l'utilità su grandi numeri.
Nella patologia che interessa l'EPR, il test di Amsler Rosso, prima di quello tradizionale, mostra soggettive alterazioni, mentre nella alterazioni epiretiniche iniziali si altera prima il test di Amsler tradizionale, sfondo nero e righe bianche o anche quello a sfondo blu e righe gialle, Amsler Blu/Giallo. Questa è la mia esperienza clinica sul campo, che necessita naturalmente di conferme.
Tutto dipende dal modo di eseguire il test: a 50 cm con correzione per vicino, con un occhio per volta con schermo TV Topcon CP 22 che utilizzo da tempo come ottotipo, per standardizzare, per quanto possibile, il test per illuminazione e inclinazione della griglia rispetto all'asse visivo, essenziale per risposte più sicure.
In data 09/05/13 ho ricevuto con positiva sorpresa dalla ditta farmaceutica Pfeizer in omaggio un test di Amsler che presenta test in colore di sfondo nero e righe rosse, oltre al tradizionale. Quest'idea da me manifestata inutilmente da anni a molte case farmaceutiche con interesse per la macula, ho piacere che infine sia stata accolta, senza solleciti diretti, da un partner importante della farmacologia mondiale che non ha interessi diretti nella terapia delle maculopatie. A riprova che la mia idea era valida e che gli altri protagonisti della farmacopea oftalmologica sono stati stoltamente sordi, anche contro i loro stessi interessi.
In data 02/09/13 la Théa ha infine accolto la mia idea e sta distribuendo tavole con i test di Amsler Multicolor assolutamente ben fatte. Anche se tardivamente ora si potrà su larga scala verificare la predittività dei test modificati da parte di tutti i colleghi.
E' chiaro che queste varianti sono utili in patologie non avanzate della neuro-retina. Essenziale prima verificare che non esistano deficit congeniti ai colori e che il visus sia ancora relativamente buono; se l'alterazione retinica è estesa in tutti gli strati retinici o il nervo ottico ha subito lesioni sulla maggior parte del contingente assonale, il test non ha validità. Assumono quindi una valenza predittiva e preventiva nelle fasi iniziali delle patologie neuroretiniche: l'esperienze che saranno raccolte e, spero comunicate, potranno confermare le opportunità diagnostiche di un test a nostra disposizione da quasi un secolo, a basso costo e alla portata di tutti.
torna al menù
Test di Schirmer
Il test è un indicatore della somma delle così dette secrezioni basale e riflessa. Si esegue in ambiente poco illuminato, apponendo una cartina nel fornice inferiore al canto esterno e se ne misura l'impregnazione dopo 5 minuti, avendo il paziente tenuto gli occhi chiusi. E' stato proposto nel 1903 ma tuttora è il più usato come test di I° livello nella pratica ambulatoriale.Fornisce certamente informazioni interessanti sulla capacità di secrezione lacrimale dell'occhio in esame, tuttavia deve essere condotto con procedure standardizzate in quanto esistono molte variabili che intervengono nel determinare il valore.
La più importante variabile deriva dal fatto che l'assorbimento da parte della striscia di carta bibula e la lunghezza della porzione bagnata vengono influenzati dalla forza di capillarità e bagnabilità proprie delle fibre di cellulosa ; ecco perché è importante eseguire il test con cartine validate.
Sebbene il limite dei valori normali sec. Schirmer fosse una impregnazione superiore ai 15mm, oggi si è d'accordo nel definire come franca iposecrezione lacrimale una impregnazione < 5mm/5' ma già pre-patologica a 6 -10mm/5'
Test della secrezione basale (Test di Jones)
Variante del Test di Schirmer I, fa precedere l'instillazione di una goccia di anestetico locale all'inserimento della cartina, meglio previa asciugatura del fornice inferiore, poi le restanti fasi sono del tutto simili. Valore del Test di Schirmer I -- Valore del Test di Jones = Valore Secrezione riflessaTest di Schirmer II
Il test è un indicatore della così detta secrezione riflessa. Utilizza la consueta striscia di carta bibula, inserita al fornice inferiore dopo instillazione di anestetico locale. La secrezione riflessa viene stimolata mediante un cotton fioc inserito nella mucosa nasale. Il valore di tale secrezione verrà letto dopo 2'. Valori < 15 mm / 2' sono significativi di una iposecrezione riflessa.Test di Schirmer III
È simile al test di Schirmer II, da cui differisce solo per la sorgente di stimolo della secrezione lacrimale riflessa, che in questo caso è la luce solare. Tralasciando ulteriori varianti proposte in letteratura, i vari test di Schirmer sono forse criticabili soprattutto per le tante variabili in gioco durante le misure; tuttavia, il loro uso nella pratica quotidiana è estremamente utile per la diagnosi corretta delle situazioni di ipolacrimia in molti pazienti, tanto da rendersi indispensabili fintanto che non verrà proposta una valida alternativa che coniughi semplicità e qualità.torna al menù
Le tipologie di chirurgia
La Chirurgia del Segmento Anteriore
La Chirurgia rifrattiva
La Chirurgia del Segmento Posteriore
torna al menùData ultimo aggiornamento pagina: 07/12/2016