Il glaucoma tipologie diagnosi cure e trattamenti
- ARVO 2011 - Visionary Genomics
- Campo visivo e glaucoma
- Che cos'è il glaucoma
- Diminuzione del campo visivo
- Esami strumentali
- Fattori di Rischio e Tipi di Glaucoma
- Nuove tecnologie di Imaging per il Glaucoma
- Ocular Hypertension Treatment Study 2 (OHTS 2)
- Ocular hypotensive effect of oral Palmitoyl-ethanolamide: a clinical trial
- OCT e Glaucoma
- Palmitoylethanolamide exerts neuroprotective effects in mixed neuroglial cultures and organotypic hippocampal slices via peroxisome proliferator-activated receptor-a
- Perimetro automatico HFA 750i
- The endogenous fatty acid amide, palmitoylethanolamide, has anti-allodynic and anti-hyperalgesic effects in a murine model of neuropathic pain: involvement of CB1, TRPV1 and PPARc receptors and neurotrophic factors
- The Ocular Hypertension Treatment Study
- Terapia del glaucoma
- Test di Screening
Che cos'e il glaucoma
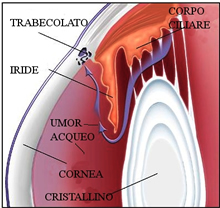 Il glaucoma è spesso ritenuto dall'opinione pubblica una malattia grave e viene associato mentalmente alle neoplasie.
Il glaucoma è spesso ritenuto dall'opinione pubblica una malattia grave e viene associato mentalmente alle neoplasie.Nulla di più errato ed inesatto.
La percentuale di persone con deficit importanti visivi per glaucoma è oggi sempre meno rilevante, essendo a disposizione cure efficaci che permettono di arrestare il danno dovuto alla pressione oculare sul nervo ottico.
Questa malattia si instaura quando il tono oculare diviene dannoso per le strutture nervose del bulbo oculare.
A livello retinico il nervo ottico è visibile come un disco giallo-roseo che ricorda un sole al tramonto. Le informazioni visive partono dalla retina, vengono convogliate al disco ottico e da questo al nervo che trasmette al cervello tutte le informazioni ricevute.
 Il disco o papilla ottica è quindi la parte del nervo ottico visibile oftalmoscopicamente all'esame del fondo oculare.
Il disco o papilla ottica è quindi la parte del nervo ottico visibile oftalmoscopicamente all'esame del fondo oculare.Questa struttura nervosa risente della tensione bulbare e le sue fibre nervose, che sono perenni e non rinnovabili nel corso della vita, diminuiscono sensibilmente con l'aumento del tono oculare, oltre che fisiologicamente nel corso degli anni.
Tale diminuzione, se avviene lentamente come nel glaucoma cronico, genera un danno poco rilevante soggettivamente e quantificabile solo con un esame del campo visivo, o meglio ancora con la misurazione dello spessore delle fibre stesse, con le nuove attrezzature oggi a nostra disposizione, come l'OCT Status, il GDX, l'HRT.
E' quindi una malattia frequentemente silente e viene scoperta casualmente nel corso di comuni visite di controllo oculistiche.
Ha una certa estrinsecazione familiare, con frequenza variabile, costituendo questo aspetto un carattere da indagare e tenere presente nella valutazione complessiva del paziente.
Un controllo del tono oculare è il primo passo verso una diagnosi che si basa sullo stato della papilla ottica e del campo visivo.
Campo visivo e glaucoma
di Jean-Philippe Nordmann da glaucomaworld.net
La valutazione del campo visivo è un esame fondamentale nel glaucoma.È attualmente la tecnica a cui viene riconosciuta maggiore importanza per stabilire la diagnosi e per controllare l'andamento nel tempo dei pazienti affetti da glaucoma primario ad angolo aperto. Sono disponibili svariati tipi di strumenti e di programmi e questo solleva alcuni interrogativi: dobbiamo preferire apparati che impiegano metodi cinetici o statici, dobbiamo privilegiare esami di screening o determinazioni di soglia?
La risposta è in realtà estremamente lineare: il modo migliore di evidenziare le più precoci alterazioni nel glaucoma è di praticare una valutazione di soglia dei 30 gradi centrali del campo visivo mediante perimetria statica.
Esami di screening evidenzierebbero solo scotomi più profondi di 6 decibel e la classica perimetria cinetica di Goldmann non sarebbe in grado di evidenziare perdite diffuse o piccoli scotomi.
Inoltre, la perimetria automatica consente di memorizzare l'esame, per comparare mediante analisi statistica i risultati del singolo paziente con quelli di soggetti normali della stessa età e di monitorare le variazioni nel tempo per ogni paziente.
In pratica i programmi 24-2 o 30-2 dell'Humphrey Field Analyser o i programmi G1 o G2 del perimetro Octopus sono quelli usualmente impiegati. Risultati perimetrici anormali sarebbero da comparare con quelli che ci si aspetta di trovare in caso di glaucoma, per valutare la significatività del difetto.
I difetti iniziali sono tipicamente di due tipi: difetti fascicolari e depressioni generalizzate del campo visivo.
Difetti fascicolari
La natura dei difetti fascicolari è da porsi in relazione con la topografia delle fibre del nervo ottico a livello della papilla. Reperti comuni nei glaucomi iniziali sono:- "Salto" nasale: il c.d. salto nasale (una scalinatura dell'isoptera; (fig. 1) viene spesso localizzato tra i 20° e i
30° dal punto di fissazione e può estendersi ulteriormente in periferia. Se nei 30° centrali è presente un salto nasale, sia di tipo
assoluto che relativo, vale la pena di controllare la visione periferica, in modo da definire l'estensione dello scotoma.
Nel 5% dei casi, infatti, il salto nasale è presente perifericamente ai limiti esterni dell'isoptera dei 30°, e pertanto non viene evidenziato con la perimetria centrale convenzionale. - Deformazioni della macchia cieca: ingrandimenti omogenei della macchia cieca, relativamente comuni in
pazienti miopi o anziani, non sono un sintomo di glaucoma iniziale.
Tuttavia, in caso di glaucoma si può osservare una deformazione verticale della macchia cieca che di solito configura un difetto arcuato iniziale ad andamento leggermente curvilineo; viene chiamato scotoma di Seidel. - Scotoma paracentrale: gli scotomi focali paracentrali vengono di solito evidenziati all'interno dei 20° centrali.
In caso di depressione paracentrale poco profonda, il modo di progressione tipico è un approfondimento e un allargamento.
Se questi scotomi hanno una dimensione inferiore a 6°, possono non essere evidenziati dalla perimetria, in quanto col programma 30-2 gli stimoli vengono presentati nell'area centrale ogni 6° e un poco più ravvicinati con il programma G1.
In caso di scotoma paracentrale vicino al punto di fissazione è consigliabile misurare la soglia foveale, per evidenziare un possibile difetto centrale. - Difetti arciformi: un difetto di forma arcuata, o scotoma di Bjerrum, è un segno attendibile di perdita glaucomatosa
del campo visivo. Prende l'aspetto di uno scotoma che circonda il punto di fissazione.
La sua estremità nasale può arrivare entro i 10° dal punto di fissazione o situarsi più lontano. Molti difetti arciformi sono collegati con la macchia cieca, mentre altri rimangono separati da essa.
In molti casi, scotomi di vario tipo osservati inizialmente (salto nasale, scotoma paracentrale; si allargano successivamente e formano un difetto arciforme riempiendo l'intera area arcuata che va dalla macchia cieca al rafe mediano. - Difetti periferici iniziali: difficilmente i difetti iniziali appaiono al di fuori dei 30° centrali.
In tale caso, questi scotomi configurano o un salto nasale, o un salto verticale, oppure un difetto temporale a settore.
Con la perimetria automatizzata è prassi comune misurare solamente il campo visivo centrale, ignorando pertanto la periferia. A seconda del metodo d'esame, quando si esplora l'intero campo visivo è presente una alterazione del campo visivo periferico senza modifiche nei 30° centrali dal 3 al 10% dei pazienti.
In caso di glaucoma moderato o grave, una alterazione periferica è molto più frequente.
Depressione diffusa del campo visivo
Una depressione generalizzata del campo visivo è in molti casi una diretta conseguenza di una pressione intraoculare eccessiva. Con la perimetria automatizzata, un difetto diffuso si caratterizza per un MD (Difetto Medio o Deviazione Media) alterato e una PSD (Pattern Standard Deviation, nel perimetro Humphrey) o LV (Varianza della perdita, nel perimetro Octopus) che rimangono entro limiti normali.Con la perimetria cinetica di Goldmann, una perdita diffusa si traduce in un restringimento concentrico generalizzato della macchia cieca. Queste alterazioni diffuse scompaiono con la riduzione medica o chirurgica della pressione intraoculare.
Una depressione diffusa è considerata come un segno iniziale di glaucoma. Tuttavia questo segno è aspecifico, perché presente in molte patologie caratterizzate da un'opacità dei mezzi diottrici.
Conclusioni
Negli ultimi quindici anni, la perimetria automatizzata ha cambiato il nostro modo di valutare le alterazioni iniziali della funzione visiva nel glaucoma. Ad esempio, nel passato il glaucoma era considerato come una malattia che interessava inizialmente la periferia.Oggigiorno, l'accurata analisi statica delle isoptere centrali dimostra che i primi difetti sono in molti casi localizzati entro l'area centrale. Impiegando altre tecniche di valutazione visiva, come la sensibilità al contrasto o la percezione dei colori, sembrerebbe anche che la visione maculare e foveale sia interessata nelle prime fasi della malattia.
Un paragone tra l'analisi istologica delle fibre nervose ed i risultati perimetrici dimostra che si possono perdere fino al 40% delle fibre, prima di evidenziare una alterazione mediante la perimetria di Goldmann.
La perimetria automatica consente una migliore sensibilità, in quanto si osservano alterazioni già con una perdita del 10-15% di cellule ganglionari. Tuttavia, soprattutto in soggetti giovani con ipertensione oculare marcata, le alterazioni del campo visivo possono essere ritardate, per merito della grande plasticità del sistema visivo.
In questi casi, nel valutare la gravità del glaucoma l'analisi morfologica della papilla potrebbe rivelarsi più efficace.
Fattori di Rischio e Tipi di Glaucoma
Tutti sono a rischio di glaucoma. Tuttavia esistono persone più a rischio rispetto ad altre. Persone con fattori di rischio importanti dovrebbero sottoporsi a visite oculistiche di controllo ogni anno dopo i 45 anni, ed eseguire almeno una volta tests di screening da utilizzare come confronto negli anni futuri. Ecco una lista dei principali fattori di rischio per glaucoma:Età superiore a 60 anni
Il glaucoma è più comune nelle persone anziane. Il rischio di sviluppare la mattina cresce fino a sei volte oltre i 60 anni.Familiarità
Avere parenti diretti affetti da glaucoma aumenta il rischio di sviluppare la malattia da 4 a 9 volte rispetto alla popolazione normale.Utilizzo di corticosteroidi
Numerosi lavori scientifici dimostrano che l'utilizzo prolungato di corticosteroidi (soprattutto a livello topico sul viso) comporta un incremento della pressione oculare con aumento del rischio di glaucoma. Esiste inoltre una discreta quantità di paziente che risponde all'uso topico di cortisone con un acuto ed importante rialzo della IOP.Spessore corneale ridotto
Uno spessore corneale ridotto (inferiore a 500 micron) aumenta il rischio di sviluppare glaucoma.Traumi Oculari
Traumi oculari possono provacare alterazioni della zone di scarico oculare con conseguente rialzo dell IOP. Attivitò sportive come la boxe o il baseball posso essere la causa di glaucomi traumatici, che si possono verificare immediatamente dopo il trauma o anche a distanza di anni.Persone appartenenti a particolari gruppi etnici
Il glaucoma è da 6 a 8 volte più frequente nella razza afro-americana rispetto a quella caucasica. La razza asiatica è a maggior rischio per il glaucoma acuto da chiusura d'angolo. Recenti studi dimostrano che la popolazione ispanica presenta rischio maggiore per glaucoma rispetto a quella europea.Tipi di Glaucoma
Esistono diversi tipi di glaucoma. I due principali sono quello ad angolo aperto e quello ad angolo stretto (o chiuso). Sono entrambi caratterizzati da un aumento della pressione intraoculare (IOP). Ecco una lista dei principali tipi di glaucoma :- Glaucoma primario ad angolo aperto
- Glaucoma ad angolo stretto
- Glaucoma congenito
- Glaucoma a bassa pressione
- Glaucoma secondario
- Glaucoma pseudoesfoliativo
- Glaucoma pigmentario
- Glaucoma neovascolare
- Glaucoma traumatico
Esempi di diminuzione del campo visivo per glaucoma
 Lo scopo della terapia del glaucoma è quello di mantenere costante la pressione oculare al di sotto dei valori massimi
tollerabili, evitando così che l' occhio subisca altri danni.
Lo scopo della terapia del glaucoma è quello di mantenere costante la pressione oculare al di sotto dei valori massimi
tollerabili, evitando così che l' occhio subisca altri danni.All'inizio la terapia è sempre a base di colliri; si può intervenire con il laser o chirurgicamente se la terapia medica risulta inadeguata.
Il dato dello spessore corneale è importante per conoscere il vero valore del tono oculare.
Questo studio ha un brevetto nazionale ed internazionale per aver individuato per primo la relazione tra tono e spessore corneale.
Esami strumentali fondamentali per il glaucoma
 Campo Visivo Computerizzato
Campo Visivo Computerizzato l'esame del campo visivo è l'esame fondamentale, insieme alla misurazione del tono oculare, da effettuare periodicamente (da un minimo di 6 mesi ad un massimo di 1 anno)nello studio dell'andamento del glaucoma.
 Esame della papilla ottica con OCT o HRTe delle fibre ottiche
Esame della papilla ottica con OCT o HRTe delle fibre otticheper lo studio dettagliato della retina nelle maculopatie e del nervo ottico nella malattia glaucomatosa.
 Esame fotografico della papilla ottica
Esame fotografico della papilla otticafotografia e filmato delle patologie oculari con stampa immediata, per seguire le patologie nel tempo e la loro evoluzione.
Tale metodica è specialmente opportuna nelle maculopatie e nelle patologie del nervo ottico e specificatamente nel glaucoma.
 Esame pachimetrico
Esame pachimetrico il pachimetro tratta la misurazione, con varie modalità, dello spessore della cornea ovvero del tessuto trasparente anteriore dell'occhio. Viene utilizzato prima di iniziare la terapia medica.
Perimetro automatico HFA 750i (da Zeiss)
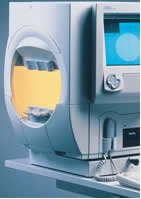 Il Perimetro automatico HFA II 750i è concepito per soddisfare le necessità di professionisti, istituzioni e organizzazioni
per i quali l'obiettivo primario è di operare con uno strumento che rispetti tutti gli standard di Goldmann e possa
attivare tutte quelle analisi universalmente riconosciute, sia statistiche che di strategia operativa, quale ad esempio
Statpac II, al fine di emettere diagnosi sullo stato funzionale del campo visivo di ogni paziente.
Il Perimetro automatico HFA II 750i è concepito per soddisfare le necessità di professionisti, istituzioni e organizzazioni
per i quali l'obiettivo primario è di operare con uno strumento che rispetti tutti gli standard di Goldmann e possa
attivare tutte quelle analisi universalmente riconosciute, sia statistiche che di strategia operativa, quale ad esempio
Statpac II, al fine di emettere diagnosi sullo stato funzionale del campo visivo di ogni paziente.Una completa gamma di test, sia di soglia che di screening, provvede a fornire un'adeguata flessibilità nell'impostazione degli esami e delle strategie, al fine di soddisfare tutte le necessità di analisi.
Un esclusivo test, denominato test di Esterman, consente di effettuare un esame funzionale medico-legale binoculare, basato su 120 siti testati con assegnazione di un punteggio percentuale sulla funzionalità retinica.
 Questo modello possiede un sistema esclusivo di allineamento della fissazione del paziente denominato
"Gaze Traking",il quale, in tempo reale, controlla e riposiziona in maniera automatica, la
fissazione del paziente.
Questo modello possiede un sistema esclusivo di allineamento della fissazione del paziente denominato
"Gaze Traking",il quale, in tempo reale, controlla e riposiziona in maniera automatica, la
fissazione del paziente.Inoltre, l'altrettanto esclusivo sistema denominato "Head Tracking", che riposiziona in maniera molto accurata la fissazione del paziente, consente all'operatore di non essere costantemente presente durante lo svolgimento dell'esame, poichè il sistema stesso provvede a trascrivere su di un grafico tutte le informazioni relative all'attendibilità dell'esame, semplificandone l'esecuzione.
L'acquisizione in automatico, durante l'esame, del diametro della pupilla del paziente, ne facilita l'interpretazione.
Un Hard Drive di 2.2 GB ed un pacchetto completo di analisi software cosi' come: Overview Analysis e l'esclusivo "Glaucoma Change Probability" possono monitorare nel tempo lo stato funzionale del campo visivo di ogni paziente.
 Il Test Cinetico è compreso nelle varie strategie di esami attivabili in questo modello, così come il rivoluzionario SITA e
SITA Fastpac, speciale e unico algoritmo di soglia interattivo con il paziente che consente in un tempo dimezzato rispetto
ai convenzionali esami di soglia, di aumentare sia l'accuratezza (ripetitibilità dei risultati) sia la sensitività degli
stessi, analizzando, nel caso del SITA, il 100% delle informazioni fornite dal paziente.
Il Test Cinetico è compreso nelle varie strategie di esami attivabili in questo modello, così come il rivoluzionario SITA e
SITA Fastpac, speciale e unico algoritmo di soglia interattivo con il paziente che consente in un tempo dimezzato rispetto
ai convenzionali esami di soglia, di aumentare sia l'accuratezza (ripetitibilità dei risultati) sia la sensitività degli
stessi, analizzando, nel caso del SITA, il 100% delle informazioni fornite dal paziente.Inoltre questo modello incorpora inoltre il test Blue/Yellow ed il software di analisi statistica Statpac per Blue/Yellow.
Questa strategia di esame consente, come da comprovati studi clinici, di verificare una perdita di campo visivo in maniera molto precoce rispetto alla tradizionale perimetria bianco su bianco.
Uno streamer tape-drive back-up incorporato, consente una veloce ed efficiente archiviazione supplementare di tutti i dati.
La possibilità di aggiornare lo strumento con successivi up-grade sia software che hardware, lo rende realmente versatile e compatibile con ogni necessità operativa.
Lo strumento è completo di tavolo elettrico, tastiera e stampante.
Nuove tecnologie di Imaging per il Glaucoma
Articolo a cura di Dr. Enrico RotondoQuesta review si propone di descrivere le differenti tecnologie attualmente disponibili nella pratica clinica, per l’imaging del disco ottico e dello strato delle fibre nervose retiniche (RNFL).
L’importanza dei cambiamenti morfologici del disco ottico nella diagnosi e nel management del glaucoma è ben conosciuta. I metodi convenzionali di esame includono l’osservazione dellla papilla ottica e l’analisi soggettiva di una stereofoto da parte di un oftalmologo esperto.
Recentemente sono stati introdotti nuovi metodi di valutazione del disco ottico: Confocal laser ophthalmoscopy (CSLO), Scanning laser polarimetry (SLP) e Optical Coherence Tomography (OCT). Individuando i punti di forza ed i limiti di queste tecnologie, è possibile valutare meglio il loro uso nella pratica clinica.
Introduzione
Il glaucoma è una patologia caratterizzata da aumento della pressione oculare che determina, se non curato,la progressiva sofferenza e morte delle cellule gangliari della retina.La diagnosi di glaucoma e la progressione della malattia si basano sull’ identificazione delle anomalie e dei cambiamenti della testa del nervo ottico e dello strato delle fibre nervose retiniche (RNFL). Tali cambiamenti strutturali precedeno le variazioni che possono essere rilevate all’esame del campo visivo.
Sebbene l’esame clinico del disco ottico sia indispensabile per la diagnosi del glaucoma, l’imaging della testa del nervo ottico e delle RNFL è raccomandato per una documentazione oggettiva del danno glaucomatoso.
Una varietà di nuove tecniche come l’HRT, il GDx e l’OCT sono stati creati e sviluppati per la valutazione del nervo ottico e dell’ RNFL. Queste tecnologie di imaging forniscono misurazioni oggettive che sono altamente riproducibili e mostrano un grande accordo con le valutazioni cliniche.
Tuttavia poiché l’ affidabilità diagnostica di queste tecniche di imaging non è sufficientemente alta, la valutazione del disco ottico tramite stereofoto da parte di personale esperto, rimane ancor oggi il gold standard per la diagnosi di glaucoma.
Nonostante ciò lo scopo di questo articolo è di valutare il ruolo delle tecniche di imaging nella diagnosi di glaucoma.
Scanning Laser Polarimetry (GDX)
Il GDx (GDx Nerve Fiber Analyzer; Carl Zeiss Meditec, Inc., Dublin, USA), è utile per quantificare lo spessore delle fibre nervose retiniche peripapillari, il cui assottigliamento è dovuto alla perdita di cellule ganglionari retiniche e dei loro assoni.Il principio del GDx è basato sulla misurazione di un ritardo di fase nel backscattering della luce che passa attraverso un’area birifrangente di RNFL. Sebbene il ritardo sia considerato proporzionale allo spessore dell’RNFL, si possono avere artefatti da parte di altri tessuti oculari, in particolare della cornea, che interferiscono con una valutazione accurata dello spessore.
Al fine di ridurre gli artefatti e per una migliore compensazione della birifrangenza corneale, è stato sviluppato il GDx with variable corneal compensation (GDx VCC), che ha una migliore abilità diagnostica rispetto al GDx with fixed corneal compensation (GDx FCC). Nonostante ciò si possono verificare interferenze con altre strutture sub retiniche e l’immagine prodotta dale GDx VCC può mostrare un atipico ritardo di pattern. Il nuovo Enhanced Corneal Compensation (GDx ECC) è stato recentemente introdotto per migliorare il signal-to-noise ed eliminare gli artefatti associati ad ARP. Confrontato con il GDx VCC, il GDx ECC ha dimostrato una più alta accuratezza diagnostica ed una migliore relationship struttura-funzione.
Un recente articolo di Medeiros, Vizzeri et al. Ha dimostrato che l’imaging dello strato delle fibre nervose retiniche mediante GDx VCC è superiore alla valutazione topografica del disco ottico mediante HRT nel rilevamento del danno precoce in pazienti con glaucoma sospetto. SLP-VCC e CSLO mostrano una simile relationship con la Perimetria Automatica Standard (SAP).
Confocal Scanning Laser Ophthalmoscope (CSLO)
CSLO è una tecnica usata per fornire una mappa topografica della superficie retinica e, in particolare, della testa del nervo ottico (ONH), oltre a dare una stima dello spessore dell’RNFL attorno alla testa del nervo ottico.L’ultimo CSLO è l’HRT 3 (Heidelberg Engineering). In breve, un’immagine topografica tridimensionale è costruita a partire da piani assiali multifocali attorno alla papilla ottica. Una media di tre scansioni consecutive è ottenuta per formare una singola immagine per l’analisi. Un esaminatore esperto deve tracciare i margini del disco ottico sull’immagine topografica ottenuta. Una volta ottenuta la countur line, il software calcola automaticamente tutte le misure del disco ottico.
Il Moorfields regression analysis (MRA) è stato sviluppato per migliorare l’accuratezza diagnostica dell’HRT 2. Questo algoritmo stima la rima neuroretitica globale ed in 6 settori e li compara con un database normale.
L’HRT 3 software utilizza un’analisi automatica per la valutazione del danno glaucomatoso, il glaucoma probabilità score (GPS), traccia una contour line del margine del disco ottico indipendente dall’operatore. E’ basato su modelli tridimensionali di immagini topografiche complete, che includono il disco ottico e le RNFL.
L’analisi del cup disc comprende tre misure: la dimensione, la profondità e la rima.
I parametri che vengono analizzati per le RNFL sono il raggio di curvatura verticale e orizzontale.
Un recente studio di Rao Hl, Babu GJ dimostra che la capacità diagnostica dell’HRT2 MRA è simile all’HRT 3 MRA; il GPS è più sensibile ma meno specifico del MRA nella diagnostica del glaucoma.
OCT : Tomografia a Coerenza Ottica
L’ OCT è una tecnica di imaging non invasiva utilizzata negli ultimi anni.Viene sfrutta il principio dell’interferometria dell’alta frequenza e echi bassi, per valutare lo spessore del tessuto.
L’OCT time domain con lo STRATUS OCT di terza generazione (Carl Zeiss Meditech) è stato il primo ad essere utilizzato per la diagnosi e ricerca del glaucoma.
La tecnologia di Fourier -domain recentemente sviluppata (conosciuta come Spectral-domain OCT) esegue 40.000 scan al secondo con una risoluzione di 3-6 ùm rispetto all’OCT time-domain che ha una risoluzione di 10-15 ùm. Questa tecnologia ha un esecuzione più semplice , ha una migliore abilità diagnostica nel rilevamento dei danni precoci causati dal glaucoma rispetto al time-domain OCT.
L’OCT può essere utilizzato per lo studio della testa del nervo ottico, dello strato delle fibre nervose retiniche peripapillari e della regione maculare.
Ruolo delle tecniche di Imaging
L’uso delle tecniche di imaging è diventato di uso routinario nella pratica clinica mondiale. L’HRT, IL Gdx, L’OCT forniscono misure quantitative ed oggettive che sono altamente riproducibili.Molti studi sono stati pubblicati riguardo l’alta riproducibilità di queste tecniche e del loro accordo con le valutazioni cliniche. Le tecniche di imaging permettono al clinico di valutare oggettivamente lo strato delle fibre nervose retiniche peripapillari che, a differenza del disco ottico, non possono essere visualizzate e misurate facilmente. Si è dimostrato che la variazione dello spessore delle fibre nervose retiniche peripapillari avviene precocemente in corso di glaucoma.
Inoltre le tecniche di imaging forniscono un utile mezzo per quantificare le dimensioni del disco ottico. Gli occhi affetti da ipertensione oculare che presentano anormalità all’HRT e uno spessore ridotto del RNFL misurato con l’OCT e il GDx presentano un rischio aumentato di sviluppare un glaucoma ad angolo aperto (POAG). Si rileva comunque che l’evoluzione delle tecnologie di imaging hanno un effetto negativo sugli studi longitudinali che cercano di dimostrare l’utilità dell’uso di queste tecniche per la rilevazione della progressione del glaucoma.
A tutt’oggi ci sono evidenze che le tecniche di imaging possano assistere il medico nella valutazione della progressione del glaucoma. L’imaging può anche produrre una falsa identificazione della diagnosi del glaucoma e della sua progressione. La qualità delle immagini può essere influenzata dalla opacità dei mezzi diottrici, dal movimento oculare, dal diametro della pupilla, dalla miopia e dalle variabili dipendenti dall strumento.
Perciò le informazioni ottenute dagli strumenti d’imaging dovrebbero essere considerate complementari alla altre valutazioni cliniche . Quindi la diagnosi di glaucoma non può essere assolutamente basata sull’esclusivo uso di queste tecniche.
Tecnologie future
Un OCT di nuova generazione è l’OCT Swept-Source, che può migliorare la velocità di acquisizione delle immagini e la sensibilità. Un’altra tecnologia che inizia a suscitare interesse è l’OCT Polarization-Sensitive che ha dimostrato di fornire uno più specifico contrasto tessutale.Conclusioni
Premesso che lo studio del disco ottico tramite le stereofotografie rimane il gold standard per la valutazione del danno strutturale provocato dal glaucoma, le moderne tecnologie di imaging forniscono un contributo significativo nella diagnosi e nel follow up del galucoma.Ocular Hypertension Treatment Study 2 (OHTS 2)
A cura di Stefano Miglior Direttore della clinica oculistica del Policlinico di Monza, professore ordinario di oftalmologia all'università Milano Bicocca L'Ocular Hypertension Treatment Study 2 (OHTS2) è il naturale proseguimento dell'OHTS (uno studio prospettico multicentrico randomizzato il cui obiettivo primario era quello di testare l'ipotesi che in pazienti affetti da ipertensione oculare (OHT) l'abbassamento della pressione intraoculare (IOP) determinasse una risposta migliore, in termini di ridotta incidenza di glaucoma primario ad angolo aperto (POAG). I risultati pubblicati nel 2001 mettevano in evidenza che riducendo in modo costante la IOP del 20% era possible ridurre del 60% il rischio di sviluppare POAG a 5 anni. Oltre a questo dato, l'OHTS aveva messo in evidenza che solo una piccola quota di soggetti con OHT avrebbe sviluppato POAG dopo 5 anni se fossero rimasti senza trattamento (circa il 10%) e aveva anche individuato quail fossero I fattori predittivi utili ad individuare I soggetti con OHT ad alto o a basso rischio di sviluppare POAG. La successiva analisi combinata con l'European Glaucoma Prevention Study (EGPS) aveva poi permesso di validare il modello di rischio da potersi utilizzare clinicamente al fine di stimare il rischio di sviluppare POAG a 5 anni per ciascun individuo affetto da OHT. Il quesito scientifico alla base dell'OHTS2 è "cosa succede, in termini di probabilità di sviluppare successivamente il POAG, se il trattamento ipotonizzante viene ritardato di 7 anni?" Per rispondere a questo quesito il braccio originariamente senza trattamento dell'OHTS è stato messo in trattamento, con le stesse modalità e lo stesso obiettivo pressorio utilizzati nel braccio trattato (qualsiasi farmaco, target IOP che prevedeva una riduzione della IOP dal baseline di almeno il 20%).OHTS
Sixteen years after it began, the Ocular Hypertension Treatment Trial is still generating fresh insights into one of the most vexing questions in glaucoma care: does treating ocular hypertension delay or perhaps even prevent glaucoma? About 4-8% of people in the US over the age of 40 (4.8 to 9.5 million individuals) have ocular hypertension. When questioning standards of care in a group of that size, any conclusive data will necessarily have profound implications for the economics of healthcare delivery and, of course, the lives of millions.
Attendees of this year's AGS were given an early look at the OHTS phase 2 data by Michael A. Kass, MD, principal investigator of the long-running study, which dates back to Bill Clinton's first term in office. In his 40-minute presentation, Dr. Kass reviewed the trial's phase 1 data, published in 2002, and provided highlights of the recently-completed second phase, on which a full report appears in the March 2010 Archives of Ophthalmology.
OHTS's goals were twofold, Dr. Kass said: (1) to answer once and for all the question of whether or not early treatment confers a protective effect and (2) to identify the baseline demographic and clinical factors that would predict which patients are likely to get glaucoma. The study enrolled 1636 subjects with baseline pressures of 24 to 32 mm Hg in one eye and 21 to 32 in the fellow eye, but normal visual fields at initial presentation. Subjects were randomized to either observation or a regimen of medical therapy sufficient to reduce IOP by at least 20% (the agent was chosen at the discretion of the investigator).
At the five-year mark, the incidence of POAG was nearly 60% lower in the medication group than the observation group. OHTS phase 1, Dr. Kass said, provided proof of concept; namely, that medication reduces the incidence of POAG. It did not, however, indicate when medical therapy should begin or whether or not all ocular hypertensives should begin treatment. Those were addressed in the second phase, by splitting the study group into early-treatment and late-treatment groups. After 7.5 years of observation, patients in the phase 1 observation group were offered the option to begin therapy; those in the original treatment group simply continued therapy. The early-treatment group continued therapy for 13 years while the late-treatment group has thus far logged 5.5 years of data in phase 2. Of the original 1636 individuals enrolled in OHTS, 1159 remained in the study for the duration of phase 2. The two groups differed in medication use, owing to the course of drug development during the study period. Most of those in the early-treatment group had begun the study on beta-blockers while the late-treatment group benefited from more recent medication launches and predominantly used prostaglandin analogs.
Charting the incidence of POAG in the two groups over the 13-year span of the study shows curves that initially diverge (i.e., a higher incidence in the observation group) but then become essentially parallel as the previously-untreated patients begin therapy. "The incidence of glaucoma was not different between the observation and medication groups once patients began treatment," Dr. Kass said. "This effect appears to be relatively rapid." The median time to develop glaucoma was 8.7 years in the early-treatment group and six years in the late-treatment group. As would be expected, African American patients developed glaucoma more readily than other ethnicities; however, race is not a significant predictor in a multivariate model that accounts for central corneal thickness and baseline c/d ratio. "If we'd had 10,000 African Americans instead of 400, race may have stayed in the model," Dr. Kass said, "but this is the limits of what we can do with the data that we have." Dr. Kass's group at Washington University in St. Louis have produced a risk calculator based on OTHS data that is available here.
Using the parameters at the basis of that calculator to stratify subjects into three groups by baseline risk (low, middle and high) reveals some notable findings that have implications for care. "If you look at the difference between the medication group and the observation group, there's very little absolute reduction in the occurrence of glaucoma" among low-risk patients, Dr. Kass said. Those at low risk in the observation (i.e., late-treatment) group had a cumulative 13-year incidence of glaucoma of 8%; for the early-treatment group, the incidence was 7%. By contrast, in the high-risk stratum "there is a substantial absolute reduction in the occurrence of glaucoma in this high-risk group," he said. The high-risk, late-treatment group's cumulative incidence was 40% vs. 28% for the high-risk, early-treatment group.
There are likely to be a wide range of opinions on exactly how to incorporate these new findings into clinical practice, Dr. Kass said. "Some clinicians may elect to follow all ocular hypertensives without treatment," he observed, adding "I have no objection to that" provided the clinician is sophisticated in glaucoma diagnosis (as AGS members no doubt are) and aware of the need for timely visits and appropriate testing.
He finished up the 20th AGS lecture with the following observations and conclusions from the OTHS:
• Early medical treatment reduces the cumulative incidence of POAG; delaying treatment increases it.
• The absolute risk of glaucoma is greatest in high-risk individuals.
• Most ocular hypertensives are at low risk for glaucoma, and most low-risk patients can be followed without medication.
• Delaying treatment for 7.5 years resulted in only a small absolute increase in POAG in low-risk patients.
• Starting treatment of POAG at diagnosis has no major negative effect on prognosis over five years.
• High-risk patients may benefit from more frequent exams and early treatment, after taking into consideration factors such as patient age, health status, life expectancy and personal preference.
• For ocular hypertensives, the risk of developing glaucoma continues over at least a 15-year follow-up period.
• African Americans develop glaucoma at a higher rate despite similar treatment protocols and IOP levels. The higher incidence is related to their baseline risk factors.
• Individualized assessment of risk is useful to both patients and clinicians.
Test di Screening
HRT- Heidelberg Retinal Tomograph
Tomografia della papilla ottica che analizza la morfologia del nervo ottico. Dotata di un vasto database normativo e di un sofisticato software di follow-up, è un esame fondamentale nella diagnosi precoce grazie al suo raffinato valore predittivo.GDX
Strumento di imaging che analizza lo spessore dello strato delle fibre nervose peripapillari. Utile nella diagnosi iniziale e precoce, presenta notevoli miglioramenti nell'ultima versione prodotta.OCT
Ultimo prodotto nel panorama dell'imaging del nervo ottico, permette di analizzare con un unico strumento la morfologia del nervo ottico, lo strato delle fibre nervose e le cellule ganglionari retiniche. Ha ottime potenzialità ma un software ancora primitivo.Perimetria non convenzionale
Attraverso la stimolazione di sottopopolazioni cellulari retiniche permette di individuare difetti funzionaliprima che compaiano alla perimetria standard (FDT,FDT Matrix)
CCT - Spessore corneale centrale
Una cornea sottile è un fattore di rischio per lo sviluppo di glaucoma. Una cornea spessa è un fattore protettivo. Le misurazioni del tono oculare con tonometria ad applanazione vanno reinterpretate a seconda del valore di CCT rilevato.The Ocular Hypertension Treatment Study
Baseline Factors That Predict the Onset of Primary Open-Angle GlaucomaMae O. Gordon, PhD; Julia A. Beiser, MS; James D. Brandt, MD; Dale K. Heuer, MD; Eve J. Higginbotham, MD; Chris A. Johnson, PhD; John L. Keltner, MD; J. Philip Miller, AB; Richard K. Parrish II, MD; M. Roy Wilson, MD; Michael A. Kass, MD; for the Ocular Hypertension Treatment Study Group
Arch Ophthalmol. 2002;120:714-720.
ABSTRACT
Background
The Ocular Hypertension Treatment Study (OHTS) has shown that topical ocular hypotensive medication is effective in delaying or preventing the onset of primary open-angle glaucoma (POAG) in individuals with elevated intraocular pressure (ocular hypertension) and no evidence of glaucomatous damage.Objective
To describe baseline demographic and clinical factors that predict which participants in the OHTS developed POAG.Methods
Baseline demographic and clinical data were collected prior to randomization except for corneal thickness measurements, which were performed during follow-up. Proportional hazards models were used to identify factors that predicted which participants in the OHTS developed POAG.Results
In univariate analyses, baseline factors that predicted the development of POAG included older age, race (African American), sex (male), larger vertical cup-disc ratio, larger horizontal cup-disc ratio, higher intraocular pressure, greater Humphrey visual field pattern standard deviation, heart disease, and thinner central corneal measurement. In multivariate analyses, baseline factors that predicted the development of POAG included older age, larger vertical or horizontal cup-disc ratio, higher intraocular pressure, greater pattern standard deviation, and thinner central corneal measurement.Conclusions
Baseline age, vertical and horizontal cup-disc ratio, pattern standard deviation, and intraocular pressure were good predictors for the onset of POAG in the OHTS. Central corneal thickness was found to be a powerful predictor for the development of POAG.INTRODUCTION
THE OCULAR Hypertension Treatment Study (OHTS) was a multicenter randomized trial designed to evaluate the safety and efficacy of topical ocular hypotensive medication in delaying or preventing the onset of primary open-angle glaucoma (POAG) in individuals with elevated intraocular pressure (IOP) and no detectable glaucomatous damage. The results of the OHTS are described in detail in our companion article.1The cumulative probability of developing POAG was reduced by 60% among participants randomized to receive topical ocular hypotensive medication compared with those randomized to observation (hazard ratio, 0.40; 95% confidence interval [CI], 0.27-0.59). At 60 months, the cumulative probability of developing POAG was 4.4% in the medication group and 9.5% in the observation group.
During the planning phase of the OHTS, we identified several baseline demographic and clinical factors that might predict which participants in the trial would develop POAG. If some of these factors proved to be good predictors, clinicians could use this information to decide the appropriateness of initiating, continuing, or discontinuing topical ocular hypotensive medication in patients with ocular hypertension.
PARTICIPANTS AND METHODS
STUDY DESIGN
The protocol is described in detail in the study manual,2 in the baseline design article,3 and on the World Wide Web at www.vrcc.wustl.edu.The protocol was approved by the institutional review board of each participating clinic. In brief, 1636 participants who had ocular hypertension, with an IOP between 24 mm Hg and 32 mm Hg in one eye and between 21 mm Hg and 32 mm Hg in the other eye and no evidence of glaucomatous damage, were randomized to either observation or treatment with commercially available topical ocular hypotensive medication.
The goal of treatment with topical ocular hypotensive medication was to achieve an IOP of 24 mm Hg or less and a minimum 20% reduction from the average of the qualifying IOP and IOP at the baseline randomization visit, except that an IOP of less than 18 mm Hg was not required. The primary outcome was the development of reproducible visual field abnormality or clinically significant reproducible optic disc deterioration attributable to POAG.
Abnormalities were determined by masked certified readers at the Visual Field and Optic Disc Reading Centers, and attribution to POAG was decided by the masked Endpoint Committee.
Baseline demographic and clinical information was collected for each participant prior to randomization.
The baseline clinical examination included refraction, best-corrected visual acuity, full-threshold white-on-white Humphrey 30-2 visual field tests, IOP measurement, a dilated fundus examination, and stereoscopic optic disc photographs.
Myopia was defined as a spherical equivalent of -1.0 diopter (D) or more.
Horizontal and vertical cup-disc ratios by contour were estimated visually from stereoscopic optic disc photographs by masked certified readers in the Optic Disc Reading Center.4 Information collected by participant report included ocular and medical history, family history of glaucoma, current use of medications including oral calcium channel blockers, and oral -adrenergic antagonists. Medical history was obtained by asking, "Has a doctor ever told you that you have any of the following conditions?" and reading a list of medical conditions. Family history of glaucoma was determined by asking, "Do any of your blood relatives (biological mother or father, biological brother or sister, biological aunt or uncle, or biological grandmother or grandfather) have glaucoma?" A first-degree relative was defined as a biological parent or sibling.
During the planning phase of the OHTS, we identified several factors as possible predictors for the development of POAG.
These included age, self-identified race, sex, vertical and horizontal cup-disc ratio, IOP, family history of glaucoma, visual field indexes, myopia, heart disease, high blood pressure, low blood pressure, treatment of medical conditions with oral calcium channel blockers or oral -adrenergic antagonists, cerebrovascular accident, diabetes mellitus, and migraine.
During the course of the OHTS, increasing information indicated that thick corneas could cause overestimation of the true IOP and that individuals classified as having ocular hypertension had thicker corneas on average. We began to collect central corneal thickness measurements in early 1999, about 2 years after randomization of the last participant.
The protocol for the measurement of central corneal thickness is described in a previously published article.5 New conditions or signs that occurred during follow-up, such as optic disc hemorrhage, are not included in this article.
STATISTICAL ANALYSIS
For eye-specific variables, we calculated the mean for each eye and then averaged these 2 values to determine the baseline predictive factor. The IOP predictive factor was calculated from 4 to 6 baseline IOP measurements per eye.The visual field predictive factors (mean deviation, pattern standard deviation, and corrected pattern standard deviation) were calculated from 2 normal and reliable baseline visual fields per eye.
The central corneal thickness predictive factor was calculated from 5 measurements per eye obtained during the same visit.
Cox proportional hazards models as implemented in the PHREG program in the SAS statistical software (SAS Institute Inc, Cary, NC) were used to estimate and test factors for their association with the development of POAG.
The analysis sample for the proportional hazards models consisted of 125 randomized participants who developed POAG and 1493 randomized participants with at least 1 follow-up visit (18 of 1636 participants did not have any follow-up visits) who did not develop POAG.
The analysis data set included all data through November 8, 2001, as recommended by the Data and Safety Monitoring Committee. Median participant follow-up was 72 months.
A parsimonious model was selected using the score criterion in PHREG for comparing models containing 1 predictive factor with those containing combinations of all predictive factors.
We report hazard ratios from univariate models, which do not adjust for the presence of other factors, as well as adjusted hazard ratios from the multivariate Cox proportional hazards models. Univariate and multivariate hazard ratios for developing POAG and their 95% CIs are reported for each putative predictive factor. Statistical significance was defined as P<.05>.
Terapia del glaucoma
Trattamento farmacologico
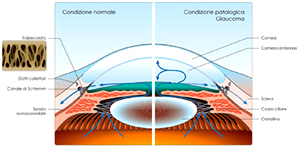
Il primo approccio terapeutico alla malattia glaucomatosa è il trattamento farmacologico, che nella maggior parte dei casi è sufficiente a controllare la progressione della patologia.I farmaci antiglaucomatosi attualmente disponibili hanno come obiettivo la riduzione della pressione intraoculare (PIO) attraverso due possibili meccanismi: la riduzione della produzione di umore acqueo oppure l’incremento del suo deflusso attraverso la via trabecolare e la via uveosclerale.
I farmaci antiglaucomatosi, in genere colliri, devono essere assunti in terapia cronica, cioè somministrati in modo regolare e costante per tutta la vita. La piena adesione alle prescrizioni terapeutiche è fondamentale perché il trattamento possa produrre i suoi effetti.
I farmaci antiglaucomatosi, in base al loro meccanismo d’azione, possono essere classificati in:
- Agonisti adrenergici, quali Epinefrina, Brimonidina, ecc
- Antagonisti beta-adrenergici, quali Carteololo, Timololo, ecc
- Analoghi delle prostaglandine, quali Latanoprost, Bimatoprost, ecc
- Inibitori dell’anidrasi carbonica, quali Dorzolamide, Brinzolamide, ecc
- Parasimpaticomimetici, quali Pilocarpina, Acetilcolina, ecc.
Terapia parachirurgica e chirurgica
In questi casi ci si può avvalere della terapia parachirurgica laser, che prevede due tipi di intervento:
- La trabeculoplastica, che viene usata prevalentemente per il glaucoma ad angolo aperto e si avvale del laser ad Argon o a Diodi.
- L’iridotomia, che viene impiegata per il glaucoma ad angolo chiuso e si avvale dell’Nd: Yag laser.
 Se la parachirurgia laser non è sufficiente ad assicurare un adeguato deflusso dell’umore acqueo, si ricorre alla terapia
chirurgica, che può essere perforante o non perforante e può avvalersi di valvole o impianti.
Se la parachirurgia laser non è sufficiente ad assicurare un adeguato deflusso dell’umore acqueo, si ricorre alla terapia
chirurgica, che può essere perforante o non perforante e può avvalersi di valvole o impianti.La tecnica perforante più diffusa è la trabeculectomia, che prevede la creazione di un canale artificiale di deflusso per l'umore acqueo, mettendo in comunicazione lo spazio tra l’iride e la cornea con quello sotto la congiuntiva.
Dal momento che questo canale non comunica direttamente con l'esterno, si forma una "bozza filtrante", cioè un rigonfiamento in cui l'umore acqueo si accumula sotto la congiuntiva prima di defluire.
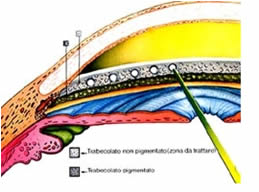 In alternativa alla chirurgia perforante si possono utilizzare delle tecniche non perforanti, che mirano a realizzare un miglior
drenaggio dell'umore acqueo attraverso le vie di deflusso tradizionali, senza creare una comunicazione diretta tra la
camera anteriore e gli spazi di filtrazione.
In alternativa alla chirurgia perforante si possono utilizzare delle tecniche non perforanti, che mirano a realizzare un miglior
drenaggio dell'umore acqueo attraverso le vie di deflusso tradizionali, senza creare una comunicazione diretta tra la
camera anteriore e gli spazi di filtrazione.La sclerectomia profonda è la tecnica filtrante non perforante più diffusa. Consiste nell’asportazione di una lamella profonda di tessuto corneo-sclerale, al disotto dello sportello sclerale, allo scopo di rimuovere la parte più interna del canale di Schlemm. Viene così mantenuta la membrana trabecolo-descemetica che modula il passaggio dell’umore acqueo verso lo spazio sottocongiuntivale.
L’intervento dura circa 20-25 minuti, presenta generalmente un’incidenza di complicanze inferiore rispetto alla trabeculectomia e un follow-up postoperatorio più semplice.
Recentemente è stato proposto un approccio chirurgico alternativo, finalizzato a realizzare il deflusso dell’umore acqueo non nello spazio sottocongiuntivale, bensì attraverso la via uveo-sclerale (spazio sopracoroideale).
Questa tecnica chirurgica, utilizzabile in casi selezionati, prevede l’innesto di un impianto biocompatibile, realizzato in oro, per mettere in comunicazione la camera anteriore e lo spazio sopracoroideale.
Si evita così la creazione di una bozza filtrante, che ancora oggi rappresenta il principale punto critico della moderna chirurgia del glaucoma.
OCT e Glaucoma
Ministero della Salute
www.glaucoma.it
www.nei.nih.gov/glaucoma/



